摘要:2022年世界肺癌大会(WCLC)于8月6日至9日在奥地利维也纳顺利召开,会议期间发表的各项研究中,AMG 510(索托拉西布,Sotorasib,Lumakras)治疗KRAS G12C突变非小细胞肺癌的成果依旧亮眼。图源国际医学会议网无药可医?KRAS突变非小细胞肺癌靶向治疗难肺癌一直是世界上发病率最高和死亡人数最多的癌症,其中非小细胞肺癌是最常见的肺癌类型,约占全球每年220万例新诊断肺癌病
2022年世界肺癌大会(WCLC)于8月6日至9日在奥地利维也纳顺利召开,会议期间发表的各项研究中,AMG
510(索托拉西布,Sotorasib,Lumakras)治疗KRAS G12C突变非小细胞肺癌的成果依旧亮眼。

肺癌一直是世界上发病率最高和死亡人数最多的癌症,其中非小细胞肺癌是最常见的肺癌类型,约占全球每年220万例新诊断肺癌病例的84%。
近年来,随着分子生物学技术的发展,非小细胞肺癌的诊疗步入新时代,靶向治疗开始发挥重要作用。研究发现某些基因的突变或异常表达是肿瘤发生的重要原因,而KRAS是非小细胞肺癌中最常见的突变致癌基因之一,其中又以KRAS G12C突变最为常见,存在于约16%的非小细胞肺癌患者中[1]。
遗憾的是,长期以来人们都几乎无法攻克KRAS,因为这种蛋白体积小、表明光滑,是一种近乎球形的结构,缺乏小分子药物的结合位点,很难合成一种能靶向结合并抑制其活性的化合物。因此KRAS一直都被称为“不可成药”的靶点,从1982年被发现以来,过去的40多年也一直没有靶向KRAS的新药问世,直到AMG 510的出现。
AMG 510是由美国安进(AMGEN)研发的一种口服KRAS G12C抑制剂,基于I/II期CodeBreaK 100试验的结果(客观缓解率为37.1%,疾病控制率达80.6%),该药于2021年5月28日获得美国食品药品监督管理局(FDA)加速批准,用于治疗至少经过一种系统性治疗失败的、携带KRAS-G12C突变的非小细胞肺癌(NSCLC)患者。
同时,它也是全球首款针对KRAS的靶向药,填补了长达40年的治疗空白,在非小细胞肺癌的靶向治疗中具有里程碑式的意义,为KRAS突变型非小细胞肺癌患者带来了生存希望。
AMG 510单药治疗已被证实有效,而此次肺癌大会则聚焦于将AMG 510分别与靶向新药和免疫药物联合使用的效果,也是AMG 510联合疗法在KRAS G12C突变非小细胞肺癌的治疗中交出的第一份答卷。
RMC-4630是赛诺菲研发的一款小分子SHP2抑制剂,同时也是继AMG 510之后的第3款KRAS靶向药。美国癌症研究学会-国际肺癌学会(AACR-IASLC)上公布的临床数据显示,RMC-4630治疗KRAS G12C突变肺癌患者的疾病控制率高达75%。
一项动物研究证实,AMG 510与SHP2抑制剂联合使用能够增强抗肿瘤疗效,因此产生了下面这项将RMC-4630和AMG 510联合应用的临床试验,1b期结果在本次会议中发布[3]。
这是一项1b期CodeBreaK 101剂量探索试验,共纳入27例KRAS G12C突变肿瘤患者,其中包括11例非小细胞肺癌患者。患者接受AMG 510(960 mg,每天一次)和RMC-4630治疗,剂量水平分别为100 mg、140 mg和200 mg,在第1天和第2天或第1天和第4天每隔7天递增一次。
在11例非小细胞肺癌患者中,3例(27%)经证实获得部分缓解(PR),其中2例在数据截止时仍处于缓解状态,7例(64%)疾病得到控制;
在接受最高剂量RMC-4630联合AMG 510治疗的4例未接受过KRAS G12C抑制剂治疗的非小细胞癌患者中,3例(75%)经证实的获得部分缓解,4例(100%)疾病得到控制。
71%的患者出现任何级别的治疗相关的不良事件(TRAEs),最常见的是外周和局部水肿(33%)、腹泻(29%)和疲劳(14%);
剂量递增完成时未发生任何≥4级的TRAE,6例(29%)发生3级TRAEs ,其中腹泻2例,腹水、谷草转氨酶(AST)升高、结肠炎、呼吸困难、高血压、胸腔积液各1例;
2例患者出现导致RMC-4630停药的TRAEs(1例腹泻和1例腹水),1例患者出现导致RMC-4630和AMG 510停药的TRAE(AST升高)。
AMG 510联合RMC-4630在KRAS p.G12C突变的非小细胞肺癌患者中观察到有希望的临床活性,尤其是在未接受过KRAS G12C抑制剂治疗的患者中。
计划下一步开展剂量扩展试验,以进一步明确AMG 510联合RMC-4630在KRAS G12C抑制剂初治和KRAS G12C抑制剂经治的非小细胞肺癌患者中的有效性和安全性。
帕博利珠单抗(K药)和阿替利珠单抗(T药)是两种已获批的用于晚期非小细胞肺癌治疗的免疫治疗药物。临床前研究表明,AMG 510联合抗PD-1或抗PD-L1治疗可增加CD8阳性T细胞浸润,并增强抗肿瘤疗效。本次会议中发表的试验结果是靶免联合治疗非小细胞肺癌的第一份报告。
会议中,研究人员发布了1b期CodeBreak 100/101剂量探索试验的结果,该研究对AMG 510与帕博利珠单抗或阿替利珠单抗联合治疗KRAS G12C突变非小细胞肺癌的疗效和安全性进行了评估[2]。
研究共纳入58例未经 KRAS G12C 抑制剂治疗的KRAS p.G12C突变 NSCLC 患者,中位随访时间为12.8个月。研究分为12个剂量探索队列,患者分别接受不同剂量的AMG 510(120-960mg,每天一次)与静脉滴注阿替利珠单抗(1200mg)或帕博利珠单抗(200mg)联合治疗,免疫药物每3周给药一次,直到疾病进展或无法耐受。
其中,一半的队列为导入队列,这些患者先接受AMG 510单药治疗21或42天,然后接受阿替利珠单抗或帕博利珠单抗与AMG 510联合治疗;另一半为同步队列,一开始就接受AMG 510和阿替利珠单抗或帕博利珠单抗联合用药[4]。
在所有12个队列中,58例患者中有17例(29%)经证实获得缓解;在17例获得缓解的患者中,中位缓解持续时间(DOR)为17.9个月;所有58例患者的中位总生存期(OS)为15.7个月。
最常见的3-4级治疗相关不良事件(TRAE)是谷丙转氨酶(ALT)和谷草转氨酶(AST)升高,没有发生致死性不良事件。
此外,同步队列中3-4级TRAE的发生率高于既往AMG 510单药治疗中观察到的发生率,主要是肝酶升高。而导入队列中3-4级TRAE和导致治疗中止的TRAE发生的频率较低。
结果表明,将AMG 510作为免疫疗法的导入治疗在KRAS G12C突变的NSCLC患者中表现出持久的临床疗效,且3-4级TRAE的发生率较低,安全性可控。
该研究的主要作者Li博士表示,目前他们正在开展新的剂量扩展试验,研究AMG 510导入后联合帕博利珠单抗作为KRAS G12C突变的初治NSCLC患者的一线治疗。
AMG 510目前已获得美国食品药品监督管理局(2021年5月28日)、欧洲药监局(2022年1月12日)、日本厚生劳动省(2022年1月20日)的批准。
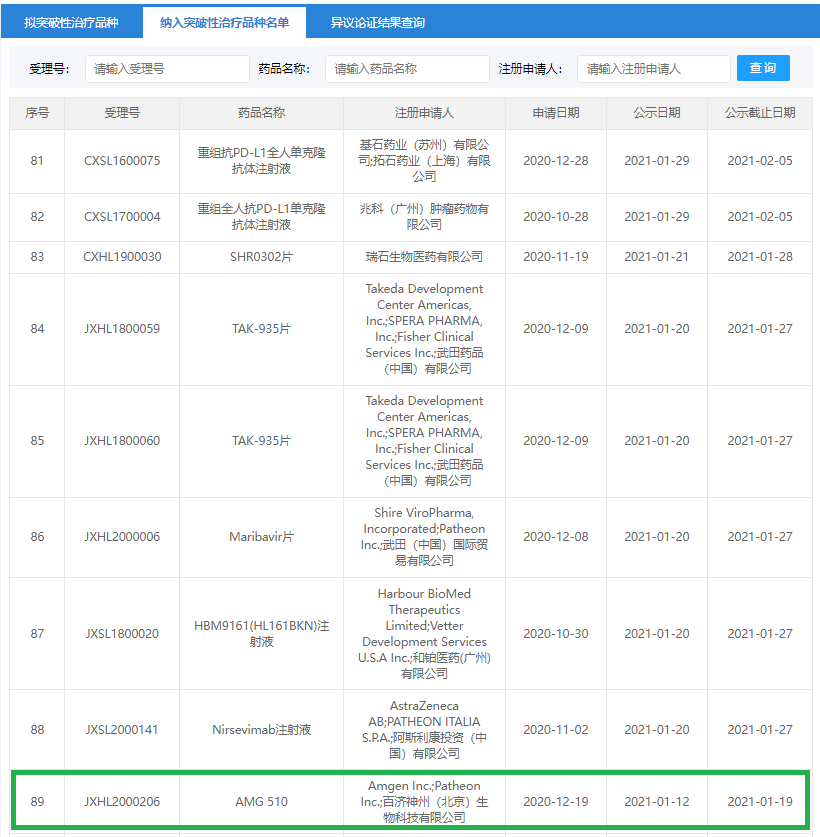
到目前为止,AMG 510还未在我国获批上市,但在2021年1月,我国国家药品监督管理局药品审评中心授予了AMG 510“突破性治疗药物”认定,这是安进首次在中国提交“突破性治疗药物”认证申请。相信在不久的将来,AMG 510必能惠及中国患者。
2022 年 5 月 26 日,美国Mirati公司公布了2期KRYSTAL-1 临床试验的最新结果,该试验评估了adagrasib(MRTX849,阿达格拉西布)在标准化疗失败后的KRAS G12C突变的晚期非小细胞肺癌患者中的疗效和安全性。同时该数据也在2022 年美国临床肿瘤学会(ASCO)年会上进行了发表。
初步试验产生了非常积极的结果,在所有可评估患者中,客观缓解率(ORR)为 43%,疾病控制率(DCR)高达 80%,中位缓解持续时间(DOR)为 8.5 个月,中位总生存期(OS)为 12.6 个月;此外,该药的安全性结果显示患者基本可以耐受。

2022年2月16日,Mirati向美国药监局递交了该药的新药申请,预计美国药监局将在2022年12月14日给出评审意见。如果能获批,意味着肺癌患者将迎来第2款KRAS靶向药。

 索托拉西布
索托拉西布 片剂
120mg*240片(美国版)|120mg*240片(德国版)|120mg*56片(孟加拉珠峰版)|120mg*56片(老挝卢修斯版)
 美国安进
美国安进
KRAS G12C突变是一种常见的肺癌驱动基因,约占非小细胞肺癌(NSCLC)患者的13%。 目前,已经有两种针对KRAS G12C突变的靶向药物获得美国FDA的批准,分别是索托拉西布(sotorasib)和阿达格拉西布(adagrasib)。
2025-10-24 09:37:29
2025-10-24 09:33:54
2025-10-24 09:30:24
2025-10-24 09:25:38
2025-10-24 09:14:12
2025-10-24 09:07:41
2025-10-24 09:02:34
2025-04-24 15:17:10
2025-04-24 15:10:38
2025-04-24 15:04:37