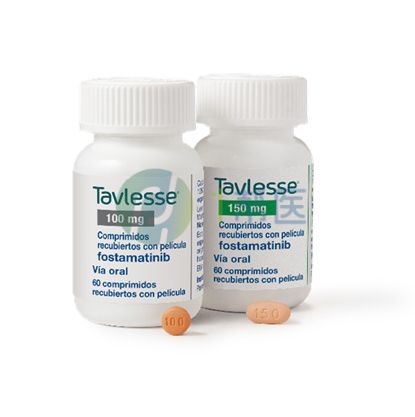
福坦替尼,也称为Tavalisse,是由美国Rigel制药公司开发的一种药物。它是脾脏酪氨酸激酶(SYK)抑制药的活性代谢产物R406的前体药物,具有多种医学治疗作用。
药品称呼
通用名称:福坦替尼
商品名称:TAVALISSETM
英文名称:Fostamatinib
中文名称:福坦替尼
全部名称:福坦替尼、Fostamatinib、TAVALISSETM
剂型和规格
1、100 mg片剂:橙色、薄膜包衣、圆形、双凸片剂,一面上刻有“100”,反面刻有“R”。
2、150 mg片剂:橙色、薄膜包衣、椭圆形、双凸面片剂,一面上刻有“150”,反面刻有“R”。
特殊人群用药
1、怀孕
根据动物研究的结果和作用机制,当对孕妇给药时,TAVALISSE(福坦替尼)可对胎儿造成伤害。
2、哺乳
目前尚无关于福坦替尼和/或其代谢产物在人乳中的存在、对母乳喂养儿童的影响或对产奶量的数据。
3、有生育能力的女性和男性
根据动物研究,当对孕妇给药时,TAVALISSE(福坦替尼)可对胎儿造成伤害。对于有生殖潜力的雌性,在开始TAVALISSE治疗前验证妊娠状态。
告知有生殖潜力的雌性在使用TAVALISSE(福坦替尼)治疗期间以及末次给药后至少1个月内使用有效避孕方法。
4、儿童用药
儿童患者的安全性和有效性尚未确定。不建议18岁以下的患者使用TAVALISSE(福坦替尼),因为在非临床研究中观察到了对活跃生长骨的不良作用。
5、老年患者用药
与年轻患者相比,在老年患者中未观察到总体疗效差异。
禁忌症
无
药物相互作用
1、其他药物对TAVALISSE的影响
1)强效CYP3A4抑制剂
与强效CYP3A4抑制剂合用会增加对R406(主要活性代谢产物)的暴露,这可能会增加不良反应的风险。监测可能需要减少剂量的TAVALISSE的毒性(参见表1)当与强效CYP3A4抑制剂同时给药时[参见“剂量和给药”]。
2)强CYP3A4诱导剂
与强效CYP3A4诱导剂合用可减少R406暴露量。不建议将TAVALISSE(福坦替尼)与强效CYP3A4诱导剂联用。
2、TAVALISSE(福坦替尼)对其他药物的影响
1)CYP3A4底物
同时使用TAVALISSE(福坦替尼)可能会增加某些CYP3A4底物药物的浓度。监测与TAVALISSE同时给药时可能需要减少剂量的CYP3A4底物药物的毒性。
2)BCRP衬底
同时使用TAVALISSE(福坦替尼)可能会增加BCRP底物药物(如瑞舒伐他汀)的浓度。监测与TAVALISSE同时给药时可能需要减少剂量的BCRP底物药物的毒性。
3)P-糖蛋白(P-gp)底物
同时使用TAVALISSE可能会增加P-gp底物(如地高辛)的浓度。监测与TAVALISSE(福坦替尼)同时给药时可能需要减少剂量的P-gp底物药物的毒性。
成分
本品的主要成分为福坦替尼
性状
白色至灰白色粉末
贮存方法
储存在室温下,20°c至25°c;允许在15°c至30°c(59°f至86oF)范围内波动[参见USP控制的室温]。
请勿移除干燥剂。
生产厂家
Rigel Pharmaceuticals,Inc.
完整说明书详情:
通用名称:福坦替尼
商品名称:TAVALISSETM
英文名称:Fostamatinib
中文名称:福坦替尼
全部名称:福坦替尼、Fostamatinib、TAVALISSETM
适应症
TAVALISSE(福坦替尼)适用于治疗慢性免疫性血小板减少症(ITP)成人患者的血小板减少症,这些患者对先前的治疗反应不足。
剂型和规格
1、100 mg片剂:橙色、薄膜包衣、圆形、双凸片剂,一面上刻有“100”,反面刻有“R”。
2、150 mg片剂:橙色、薄膜包衣、椭圆形、双凸面片剂,一面上刻有“150”,反面刻有“R”。
用法用量
1、推荐用量
1)开始服用TAVALISSE(福坦替尼),剂量为100 mg,每日两次口服。一个月后,如果血小板计数未增加至至少50 x 109/L,则将TAVALISSE剂量增加至150 mg,每日两次。
2)根据需要,使用最低剂量的TAVALISSE(福坦替尼)使血小板计数达到并保持在至少50 x 109/L,以降低出血风险。
3)TAVALISSE(福坦替尼)可与食物同服,也可不与食物同服。如果TAVALISSE的剂量漏服,则指导患者在规定时间服用下一剂药物。
2、不良反应剂量调整
基于个体安全性和耐受性,建议调整TAVALISSE剂量。某些不良反应的管理可能需要中断、减少或停用剂量。
例如,如果患者在出现不良反应时处于最大剂量,第一次剂量减少将从300mg/天减少到200mg/天。
表1:剂量减少时间表
每日剂量剂量调整
上午下午
300mg/天150mg150mg
200mg/天100mg100mg
150mg/天150mg*---
100mg/天**100mg*---
*每日一次,早晨服用TAVALISSE。
**如果需要将剂量进一步降低至100mg/天以下,则停用TAVALISSE。
不良反应的推荐剂量调整参见表2
表2:特定不良反应的建议剂量调整
不良反应推荐剂量
高血压
1期:收缩压在130-139之间或
舒张期在80-89 mmHg之间1、开始服用或增加抗高血压药物的剂量
心血管风险增加的患者,并根据需要进行调整,直至血压得到控制。
2、如果8周后未达到BP目标,则将TAVALISSE降低至下一个较低日剂量(参见表1)。
2期:收缩压至少140或
舒张期至少90 mmHg1、开始服用或增加抗高血压药物的剂量,并且根据需要进行调整,直到血压得到控制。
2、如果血压保持在140/90 mmHg或更高水平超过8周,则将TAVALISSE降低至下一个较低日剂量(参见表1)。
3、如果尽管进行了积极的降压治疗,但血压仍维持在160/100 mmHg或更高水平超过4周,则中断或停用TAVALISSE。
高血压危象:收缩压超过180
和/或舒张期超过120 mmHg1、中断或中止TAVALISSE。
2、开始服用或增加抗高血压药物的剂量,并根据需要进行调整,直至BP得到控制。如果BP恢复至低于目标BP,则恢复相同日剂量的TAVALISSE。
3、如果尽管进行了积极的降压治疗,但重复血压160/100 mmHg或更高持续4周以上,则停用TAVALISSE。
肝中毒
AST/ALT为3 x ULN或更高且小于5 x ULN如果患者有症状(如恶心、呕吐、腹痛):
1、中断TAVALISSE。
2、每72小时重新检查一次lft,直至ALT/AST值不再升高(低于1.5 x ULN),且总BL保持在2 x ULN以下。
3、在下一个较低日剂量时恢复TAVALISSE(参见表1)。
如果患者无症状:
1、每72小时重新检查一次lft,直至ALT/AST低于1.5 x ULN),且总BL仍低于2 x ULN。
2、如果ALT/AST和TBL仍属于此类,则考虑中断或减少TAVALISSE的剂量(AST/ALT为3至5 x ULN;并且总BL保持小于2×ULN)。
3、如果中断,则在下一个较低日剂量时恢复TAVALISSE(参见表1)。
AST/ALT为5 x ULN或更高,并且
总BL小于2×ULN1、中断TAVALISSE。
2、每72小时重新检查一次lft:
3、如果AST和ALT降低,则重新检查,直至ALT和AST不再升高(低于1.5 x ULN),且总BL仍低于2 x ULN;在下一个较低日剂量时恢复TAVALISSE(参见表1)。
4、如果AST/ALT在5 x ULN或更高水平下持续2周或更长时间,则停用TAVALISSE。
AST/ALT为3 x ULN或更高,且总BL大于2 x ULN停用TAVALISSE。
在无其他LFT异常的情况下,非结合(间接)BL升高继续频繁监测TAVALISSE,因为非偶联(间接)BL的单独增加可能是由于UGT1A1抑制所致
腹泻
腹泻1、在腹泻发作后尽早使用支持性措施(如饮食改变、水化和/或止泻药物)治疗腹泻,直至症状消退。
2、如果症状变得严重(3级或以上),则暂时中断TAVALISSE治疗。
3、如果腹泻改善为轻度(1级),则以下一个较低日剂量恢复TAVALISSE(参见表1)
嗜中性白血球减少症
嗜中性白血球减少症1、如果中性粒细胞绝对计数下降(ANC小于1.0 x 109/L)并在72小时后保持低水平,则暂时中断TAVALISSE直至消退(ANC大于1.5 x 109/L)。
2、在下一个较低日剂量时恢复TAVALISSE(参见表1)
不良反应
常见的不良反应:
1、腹泻、高血压、恶心、头昏眼花
2、ALT升高、AST增加、呼吸道感染、皮疹
3、腹痛、乏力、胸痛、中性粒细胞减少症
严重不良反应:
1、发热性中性粒细胞减少、腹泻、肺炎、呼吸困难
2、高血压、中性粒细胞减少、关节痛、胸痛、腹泻
3、头晕、肾结石、四肢疼痛、牙痛、晕厥和缺氧
注意事项
1、高血压
使用TAVALISSE(福坦替尼)治疗可能会出现高血压。
2、肝中毒
TAVALISSE(福坦替尼)可导致肝功能检查(lft)升高,主要是ALT和AST。
3、腹泻
31%接受TAVALISSE(福坦替尼)治疗的患者发生腹泻。
4、嗜中性白血球减少症
6%接受TAVALISSE(福坦替尼)治疗的患者出现中性粒细胞减少;1%的患者出现发热性中性粒细胞减少。
5、胚胎毒性
根据动物研究的结果及其作用机制,对孕妇服用TAVALISSE会对胎儿造成伤害。
特殊人群用药
1、怀孕
根据动物研究的结果和作用机制,当对孕妇给药时,TAVALISSE(福坦替尼)可对胎儿造成伤害。
2、哺乳
目前尚无关于福坦替尼和/或其代谢产物在人乳中的存在、对母乳喂养儿童的影响或对产奶量的数据。
3、有生育能力的女性和男性
根据动物研究,当对孕妇给药时,TAVALISSE(福坦替尼)可对胎儿造成伤害。对于有生殖潜力的雌性,在开始TAVALISSE治疗前验证妊娠状态。
告知有生殖潜力的雌性在使用TAVALISSE(福坦替尼)治疗期间以及末次给药后至少1个月内使用有效避孕方法。
4、儿童用药
儿童患者的安全性和有效性尚未确定。不建议18岁以下的患者使用TAVALISSE(福坦替尼),因为在非临床研究中观察到了对活跃生长骨的不良作用。
5、老年患者用药
与年轻患者相比,在老年患者中未观察到总体疗效差异。
禁忌症
无
药物相互作用
1、其他药物对TAVALISSE的影响
1)强效CYP3A4抑制剂
与强效CYP3A4抑制剂合用会增加对R406(主要活性代谢产物)的暴露,这可能会增加不良反应的风险。监测可能需要减少剂量的TAVALISSE的毒性(参见表1)当与强效CYP3A4抑制剂同时给药时[参见“剂量和给药”]。
2)强CYP3A4诱导剂
与强效CYP3A4诱导剂合用可减少R406暴露量。不建议将TAVALISSE(福坦替尼)与强效CYP3A4诱导剂联用。
2、TAVALISSE(福坦替尼)对其他药物的影响
1)CYP3A4底物
同时使用TAVALISSE(福坦替尼)可能会增加某些CYP3A4底物药物的浓度。监测与TAVALISSE同时给药时可能需要减少剂量的CYP3A4底物药物的毒性。
2)BCRP衬底
同时使用TAVALISSE(福坦替尼)可能会增加BCRP底物药物(如瑞舒伐他汀)的浓度。监测与TAVALISSE同时给药时可能需要减少剂量的BCRP底物药物的毒性。
3)P-糖蛋白(P-gp)底物
同时使用TAVALISSE可能会增加P-gp底物(如地高辛)的浓度。监测与TAVALISSE(福坦替尼)同时给药时可能需要减少剂量的P-gp底物药物的毒性。
成分
本品的主要成分为福坦替尼
性状
白色至灰白色粉末
贮存方法
储存在室温下,20°c至25°c;允许在15°c至30°c(59°f至86oF)范围内波动[参见USP控制的室温]。
请勿移除干燥剂。
生产厂家
Rigel Pharmaceuticals,Inc.





 美国Agios制药
美国Agios制药  在线咨询
在线咨询 
 中国亚盛医药
中国亚盛医药
 孟加拉珠峰
孟加拉珠峰
 南非Aspen
南非Aspen 用法用量
用法用量