摘要:NeoSphere证明,与安慰剂治疗组相比,帕妥珠单抗治疗组的IRF评估PFS在统计学上显著改善[危险比(HR)=0.62(95%CI:0.51,0.75),p<0.0001],PFS中位数增加6.1个月(帕妥珠单抗治疗组的PFS中位数为18.5个月,安慰剂治疗组的PFS中位数为12.4个月)。
NeoSphere(NCT00567190)是一项多中心、双盲、安慰剂对照试验,研究对象为808名HER2阳性转移性乳腺癌患者。患者按1:1的比例随机分配接受安慰剂加曲妥珠单抗和多西紫杉醇治疗,或帕妥珠单抗(Pertuzumab、Perjeta)加曲妥珠单抗和多西紫杉醇治疗。随机分组按既往治疗(既往或无既往辅助\新辅助抗HER2治疗或化疗)和地理区域(欧洲、北美、南美和亚洲)进行分层。之前接受过辅助或新辅助治疗的患者在试验注册前需要有超过12个月的无病间隔。
帕妥珠单抗的初始剂量为840 mg,随后每3周静脉注射420 mg。曲妥珠单抗的初始剂量为8 mg/kg,随后每3周静脉注射6 mg/kg。患者接受帕妥珠单抗和曲妥珠单抗治疗,直到疾病进展、同意撤回或出现不可接受的毒性。多西紫杉醇的初始剂量为75mg/m2,每3周静脉滴注一次,至少持续6个周期。如果初始剂量耐受良好,多西紫杉醇的剂量可由研究者自行决定升级至100 mg/m2。在进行初步分析时,安慰剂治疗组的研究治疗平均周期数为16.2,帕妥珠单抗治疗组为19.9。
CLEOPATRA的主要终点是由独立审查机构(IRF)评估的无进展生存率(PFS)。如果死亡发生在最后一次肿瘤评估的18周内,PFS定义为从随机化日期到疾病进展或死亡日期(任何原因)的时间。其他终点包括总生存率(OS)、PFS(研究者评估)、客观缓解率(ORR)和缓解持续时间。
NeoSphere证明,与安慰剂治疗组相比,帕妥珠单抗治疗组的IRF评估PFS在统计学上显著改善[危险比(HR)=0.62(95%CI:0.51,0.75),p<0.0001],PFS中位数增加6.1个月(帕妥珠单抗治疗组的PFS中位数为18.5个月,安慰剂治疗组的PFS中位数为12.4个月)。
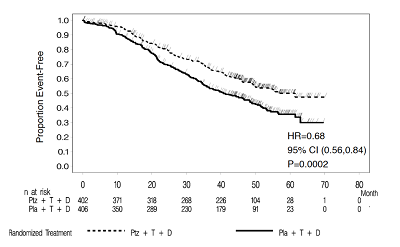
在进行最终PFS分析时,有165名患者死亡,安慰剂治疗组的死亡人数(23.6%)比帕妥珠单抗治疗组(17.2%)多;OS不成熟,中期OS分析结果不符合预先规定的统计显著性停止边界。当389名患者死亡时(安慰剂治疗组221名,帕妥珠单抗治疗组168名),进行OS的最终分析(表8,图2)。在统计学上,帕妥珠单抗治疗组的OS有显著改善[HR=0.68(95%CI;0.56,0.84),p=0.0002],中位OS增加了15.7个月(帕妥珠单抗治疗组的中位OS为56.5个月,安慰剂治疗组的中位OS为40.8个月)。
图1:NeoSphere实验中无进展生存率的Kaplan-Meier曲线分析:
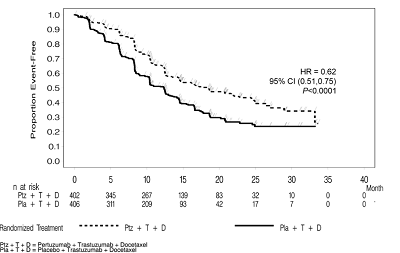
图2:NeoSphere实验中总生存期的Kaplan-Meier曲线分析:
注:Ptz+T+D=帕妥珠单抗+曲妥珠单抗+多西紫杉醇;Pla+T+D=安慰剂+曲妥珠单抗+多西紫杉醇

 帕妥珠单抗
帕妥珠单抗 注射剂
420mg/14ml
 瑞士罗氏
瑞士罗氏
治疗早期或转移性HER2阳性乳腺癌和肺癌,给药时间缩短
2025-10-01 17:19:20
2025-05-22 14:31:12
2025-05-21 17:02:45
2022-05-09 17:51:19
2023-07-12 16:19:02
2026-01-15 13:55:13
2026-01-15 13:47:42
2026-01-15 11:56:27
2026-01-15 11:40:40
2026-01-15 11:36:02