摘要:与安慰剂联合 ADT比较,恩杂鲁胺联合 ADT能明显提高转移性激素敏感性前列腺癌患者的生存期,为患者提供了一条新的治疗途径。
恩杂鲁胺(Monzalutamine)是一种由 Medivation与安斯泰来共同研发的一种临床新药,在2012年8月31日被美国 FDA批准上市,是一种新型的口服制剂。恩杂鲁胺(MDV 3100)是雄激素受体拮抗剂,其阻断雄激素结合雄激素受体并防止配体-受体复合物的核移位和共激活剂募集。恩杂鲁胺(Monzalutamine,MDV3100)是一种可抑制雄激素受体结合,阻止其入核及辅助活化因子招募的药物。MDV 3100同样具有促肿瘤细胞凋亡作用,且无激酶活性,是一种潜在的抗前列腺癌药物。

恩杂鲁胺是一种雄激素受体抑制剂,它可以竞争性地抑制雄激素与其受体的结合,还可以抑制雄激素受体的入核和与 DNA的相互作用。我们前期发现,恩杂鲁胺对 PCa细胞有明显的抑制作用,并可致PCa细胞凋亡,并可显著降低 PCa小鼠的肿瘤体积。N-去甲基化的恩杂鲁胺是其主要代谢产物,在细胞水平上具有与恩杂鲁胺类似的抑制作用。
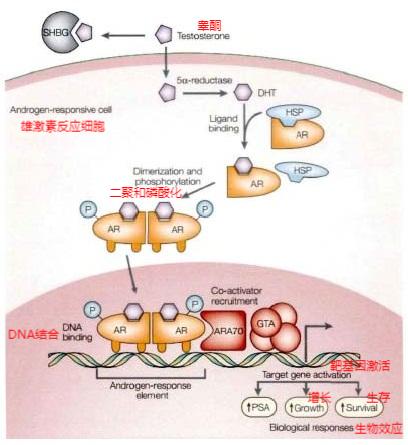
统计数据显示,在过去前列腺癌的发病率一直都是美国男性恶性肿瘤中的第一位,而在国内,它的发病率虽然远低于欧美国家,但是随着社会的发展和人们生活方式的改变,前列腺癌的发病率也有了上升趋势。除此之外,人口老龄化也是导致前列腺癌发病率上升的一个重要因素。尽管前列腺癌的早期治疗预后良好,但是患者仍然需要及时采取有效措施来预防它的发生。
2022年5月,发表在《临床肿瘤学杂志》上的一篇文章研究结果表明在转移性激素敏感性前列腺癌(mHSPC)病人中,恩杂鲁胺联合雄激素剥夺疗法(ADT)较安慰剂联合 ADT明显提高了病人的生存时间,为转移性激素敏感性前列腺癌病人提供了较好的疗效和耐受性。
虽然恩杂鲁胺联合雄激素剥夺疗法被批准用于治疗转移性激素敏感性前列腺癌,联合应用后恩杂鲁胺可明显降低转移性激素敏感性前列腺癌患者的病程和死亡风险,但其总体生存率尚不明确。因此,在本研究中对患者进行了初步的生存率分析,并对患者的影像学无进展生存率、其它次要终点指标及安全性进行了更新。纳入研究的病人按1:1随机分为两组,分别给予恩杂鲁胺(160 mg,每天1次)+抗抑郁治疗,以及安慰剂+抗抑郁治疗。这是一项非盲的研究,它将随机纳入安慰剂联合 ADT治疗的病人,并将其转至恩杂鲁胺联合 ADT治疗。生存率(关键次要终点)被定义为从随机分配到任何原因死亡的时间。研究还报告了有关影像学无进展生存期( rPFS)和其他关键次要端点的更新。与安慰剂加用 ADT相比,被随机分组的恩杂鲁胺加用 ADT的患者的死亡危险减少34%。(0.66),95% CI为0.53-0.81, P<0.001。两组的平均氧合水平都没有达到。术后第24,36,48个月,被随机分组的恩杂鲁胺联合 ADT治疗的病人生存率分别为86%,78%,71%,而安慰剂联合 ADT治疗的病人生存率分别为82%,69%,57%。
恩杂鲁胺联合 ADT较安慰剂联合 ADT可减少37%的放射疾病进展和死亡,并可增加11个月的平均影像学无进展生存期。恩杂鲁胺联合 ADT治疗组117例(20%),与安慰剂联合 ADT治疗组相比,前者有259例(45%),后者有72%的风险。安慰剂联合 ADT治疗后,患者的影像学表现及 PSA的进展均有所减缓。与安慰剂联合 ADT比较,联合 ADT组患者在影像学进展、死亡率和 前列腺特异性抗原(PSA)发生等方面均较联合 ADT组下降。恩杂鲁胺联合 ADT也推迟了第一个症状的骨反应和去势抵抗。补充资料中还报道了其它次要终点的分析结果。在其它有效结局方面,恩杂鲁胺联合 ADT比安慰剂联合 ADT更好,而且在后续的追踪中也有报道,没有任何新的安全信号发出。综合以上结果,我们认为,对恩杂鲁胺的长期应用,其耐受性好,不会产生新的毒副作用,是临床医师在对晚期前列腺癌病人进行系统治疗时,必须要考虑的一个重要因素。
表1
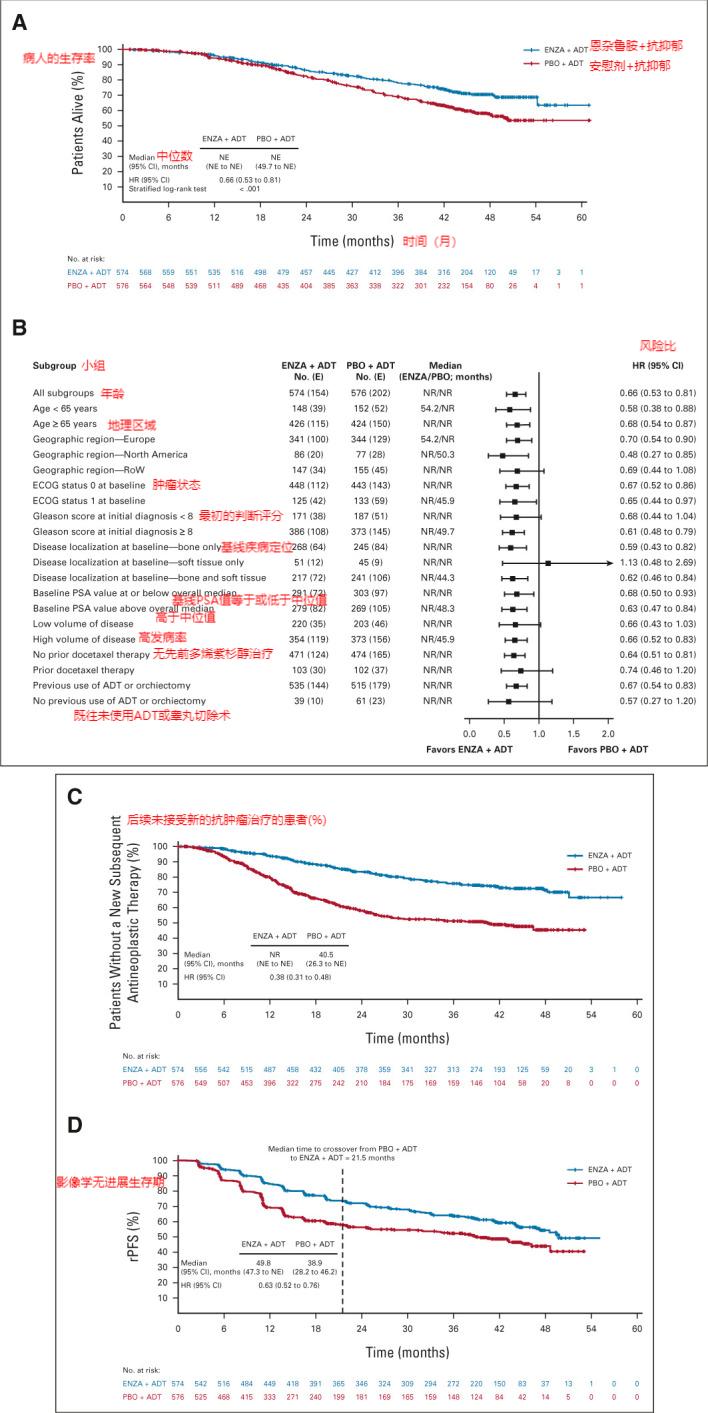
综上,与安慰剂联合 ADT比较,恩杂鲁胺联合 ADT能明显提高转移性激素敏感性前列腺癌患者的生存期,为患者提供了一条新的治疗途径。
 恩杂鲁胺(enzalutamide)
恩杂鲁胺(enzalutamide) 胶囊剂
40mg*112粒|40mg*16*7粒
 日本安斯泰来
日本安斯泰来
去势抵抗性前列腺癌患者;转移性去势敏感型前列腺癌患者以及非转移性去势敏感型前列腺癌(nmCSPC),具有高转移风险的生化复发的患者。
2025-10-02 09:06:30
2025-10-02 08:59:26
2025-10-02 08:53:33
2025-10-02 08:46:52
2025-10-02 08:43:01
2025-10-02 08:39:03
2025-10-02 08:29:52
2025-10-02 08:23:10
2025-06-16 16:15:01
2025-06-16 16:06:49