摘要:免疫靶向化疗三联疗法: 纳武单抗治疗食管胃癌缓解率超60%
2022年6月,中国国家药监局(NMPA)正式批准纳武单抗用于一线治疗晚期食管鳞状细胞癌以及辅助治疗食管癌,至此,纳武单抗成为我国首个且唯一覆盖食管胃癌一线治疗的免疫抑制剂。
食管胃癌(Oesophagogastric cancer)是胃癌、食管癌和胃食管交界处癌的统称,近几年免疫治疗在食管胃癌领域不断取得新突破,纳武单抗(Nivolumab,Opdivo)作为一种常见的免疫用药,它联合靶向药物或者化疗药物的研究成果引来广泛关注。
在刚刚结束的2022欧洲肿瘤学会(ESMO)年会中,纳武单抗联合疗法在食管胃癌领域继续展现出了优越的疗效和安全性,本文对此进行汇总分析。

前期研究表明,纳武单抗+化疗在转移性食管胃癌(EGC)患者中的总生存期优于化疗,为后续开展双药联合化疗方案提供了数据支持。本次ESMO大会中,S. Cytryn教授报告了一项单中心、2期研究(NCT04757363)的初步分析结果,该研究旨在评估瑞戈非尼联合纳武单抗和FOLFOX一线治疗转移性食管胃癌患者的疗效和安全性。
研究共入组35例HER2阴性且未经治疗的转移性食管胃癌患者,中位随访时间为7.9个月。不考虑患者的PD-L1表达状态,受试者接受瑞戈非尼(80 mg/天)、纳武单抗(240 mg,每2周一次)联合FOLFOX治疗。
主要终点是6个月无进展生存(PFS),如果35例患者中24例以上无进展,则认为该联合方案有良好的临床应用前景;次要终点包括客观缓解率、总生存期、安全性、临床获益和探索性生物标志物分析。
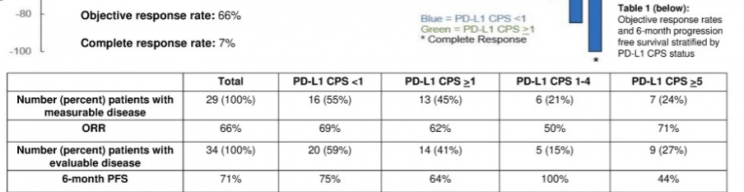
在29例有可测量病灶的患者中,90%的患者肿瘤消退(-5%至-100%);
整个队列的客观缓解率为62%(16例部分缓解,2例完全缓解),CPS<5的患者的客观缓解率为62%;CPS>5患者的客观缓解率为63%(5/8);
25例患者可进行生存评估,其中18例(72%)患者实现6个月无进展生存。其余10例患者中,9例患者在数据截至日期仍在接受治疗,但尚未达到6个月,1例已入组研究但尚未开始治疗。
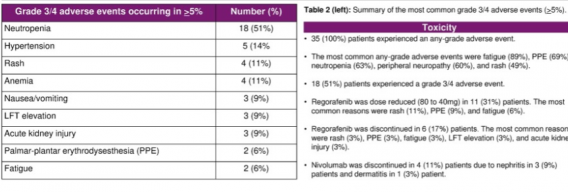
最常见的任何级别不良事件(AE)为神经病变(47%)、疲乏(47%,44%)、中性粒细胞减少症(38%)以及掌跖红肿疼痛(32%)。
71%的患者报告3/4级AE,最常见的是中性粒细胞减少症(50%)、高血压(15%)、和贫血(12%)。53%的患者因不良事件减少了至少一种药物的使用剂量,24%的患者因不良事件停药。
S. Cytryn教授表示,接受该联合方案治疗后,大多数患者获得了缓解;此外,无论患者的PD-L1表达情况如何,都没有新的安全性信号出现,总体来说安全性可控。后续研究人员还将提供更新的客观缓解率、无进展生存期、总生存期和生物标志物数据。
这项多中心研究(NCT04704154)旨在评估瑞戈非尼(Regorafenib,Stivarga)+纳武单抗在多个晚期实体瘤患者队列中的疗效和安全性,其中包含食管鳞状细胞癌(ESCC)队列,L. Bai教授在本次ESMO大会中报告了ESCC队列的中期分析结果。
每28天为一个周期,受试者在每个周期的第1天接受480 mg纳武单抗静脉注射,并在第1-21天接受90 mg/天的瑞戈非尼口服治疗。如果耐受,可从第2个周期开始将瑞戈非尼的剂量递增至120 mg/天。
研究的主要终点为客观缓解率(ORR);次要终点包括无进展生存期、总生存期和安全性。此外,研究人员还根据患者的PD-L1表达情况进行了探索性分析。
截止到2022年3月3日,37例经治的食管鳞状细胞癌(ESCC)患者中,有30例接受了治疗;21例患者(70%)的治疗尚未结束。
客观缓解率为43%,3例患者(10%)获得完全缓解,10例患者(33%)获得部分缓解;在PD-L1阳性患者(客观缓解率:83%)和PD-L1阴性患者(客观缓解率:36%)中均观察到临床缓解。
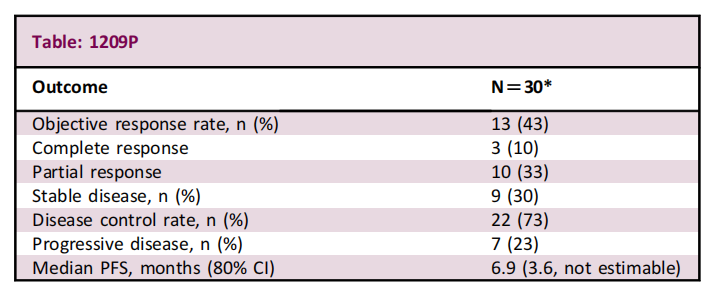
28例患者报告了治疗相关不良事件(TEAE),13例(43%)为3级,没有患者发生4/5级事件。最常见的任何级别药物相关TEAE为手足皮肤反应反应(70%)、皮疹(33%)和食欲减退(27%)。分别有3例患者(10%)和1例患者(3%)因TEAE停用纳武单抗和瑞戈非尼。
初步数据表明,无论患者的PD-L1表达情况如何,瑞戈非尼联合纳武单抗在经治患者中均表现出较好的疗效,且安全性可控。
免疫检查点抑制剂联合化疗(包括氟嘧啶和奥沙利铂)可作为胃癌的一线治疗。然而,有证据表明,微卫星高度不稳定性肿瘤患者接受纳武单抗联合伊匹单抗治疗可获得缓解,但对此类细胞毒化疗反应较差。
前期临床研究显示,纳武单抗联合低剂量伊匹单抗(Ipilimumab,Yervoy)可改善微卫星高度不稳定性结直肠癌患者的生存期,且安全性可耐受,该联合方案于2020年在日本获批。而在胃癌病例中,微卫星高度不稳定性胃癌占比最高可达5%,因此,后续又计划将该联合方案用于微卫星高度不稳定性胃癌患者,探究在这部分患者中的疗效和安全性,这就是NO LIMIT(WJOG13320G/CA209-7W7)研究的由来。
根据ESMO大会上H. Kawakami教授的介绍,NO LIMIT研究是一项单臂、开放标签、14中心的2期试验,计划入组28例患者,最多不能超过35例。2020年11月开始进行患者入组,截至2022年4月,22例已入组。目前该研究正在日本进行,受试者将接受纳武单抗(240 mg)每两周一次联合伊匹单抗(1 mg/kg)每6周一次治疗。
患者入组标准为:不可切除的晚期、复发性或转移性胃癌或食管胃结合部癌,组织学确诊为腺癌;微卫星高度不稳定性;既往未接受过全身抗癌治疗;美国东部肿瘤协作组体能评分(ECOG)为0或1;根据RECIST 1.1有可测量病灶。
研究的主要终点为客观缓解率(ORR);次要终点包括无进展生存期、总生存期、缓解持续时间、安全性、耐受性和生物标志物。
截至目前,纳武单抗+伊匹单抗组合在全球范围内已获批5个癌种的6个适应症,包括黑色素瘤、肾细胞癌、结直肠癌、肝细胞癌、非小细胞肺癌。H.Kawakami教授表示,该研究预期的客观缓解率为65%,如果最终结果达到这一数据甚至更高,意味着这一双免疫组合有望将适应症扩展到胃癌。

 纳武利尤单抗(O药)
纳武利尤单抗(O药) 注射剂
40mg/4mL100mg/10mL
 美国施贵宝
美国施贵宝
治疗转移性黑色素瘤肾癌肝癌等的免疫药,显著改善生存
2025-04-08 14:58:58
2025-04-08 14:53:24
2025-04-08 14:46:21
2025-04-08 14:37:59
2025-04-08 14:22:24
2022-05-16 18:17:22
2022-07-26 15:11:57
2022-12-21 11:13:43
2023-06-28 17:09:17
2026-01-15 13:55:13