摘要:新疗法!FDA批准恩杂鲁胺+Talzenna治疗mCRPC
2023.6.20日,辉瑞(Pfizer)公司宣布美国食品药品监督管理局(FDA)已经批准Talzenna(他拉唑帕利)联合恩杂鲁胺治疗用于HRR(同源重组修复)基因突变的转移性去势抵抗性前列腺癌(mCRPC)。

通常来说,转移性去势抵抗性前列腺癌也叫激素抵抗性前列腺癌,属于前列腺癌的终末期, 一般是指前列腺癌晚期丧失手术根治的机会,经过初次持续性内分泌治疗后疾病好转、反弹或疾病依然进展的前列腺癌。这是目前治疗前列腺的难点,在这些患者中,发生HRR(同源重组修复)基因突变的大概有20%-40%。存在这些基因突变的患者一般恶性程度更高,治疗上也有一定难度,预后较差,严重影响患者的生存质量和生存时间。尽管目前关于转移性去势抵抗性前列腺癌的治疗已经取得了进展,但是该疾病进展迅速,并且发生基因突变的可能性较高,因此也需要新的一线治疗方案来降低疾病进展或死亡的风险。
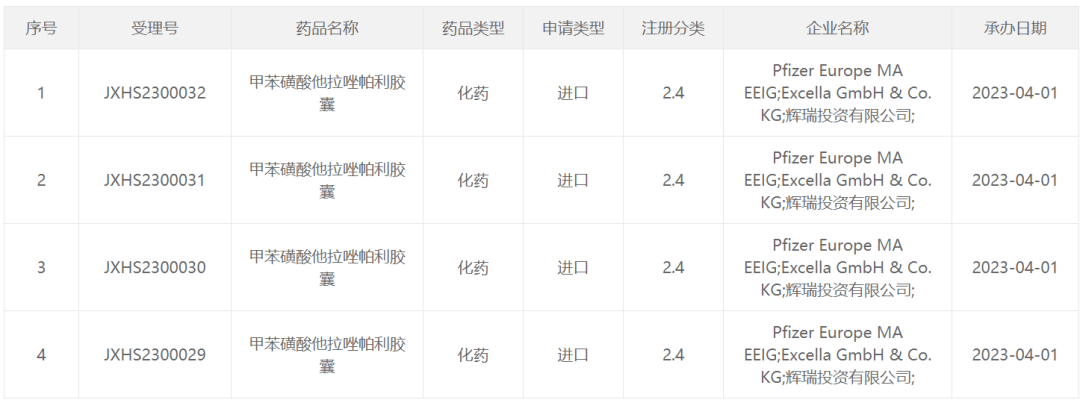
他拉唑帕利是一种口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,在DNA损伤修复中发挥重要作用。有研究证实,PARP抑制剂可以阻断PARP酶活性,并在DNA损伤部位捕获PARP,从而诱导癌细胞死亡,进一步减少癌细胞生长。该药于2018年被美国FDA批准用于治疗带有胚系BRCA基因突变、人类表皮生长因子受体2(HER2)阴性的局部晚期或转移性乳腺癌。2023年4月份,中国国家药监局药品审评中心(CDE)官网显示,接受了甲苯磺酸他拉唑帕利胶囊的上市申请,目前已经被受理。

恩杂鲁胺是一种雄激素受体拮抗剂,是治疗转移性去势抵抗性前列腺癌(mCRPC)、非转移性去势抵抗性前列腺癌、转移性去势敏感性前列腺癌的全球标准疗法。该药可以抑制雄激素与受体结合,有研究显示,恩杂鲁胺能够抑制前列腺癌细胞的增殖并诱导其死亡。
FDA批准主要是基于TALAPRO-2研究数据,该试验是一项双盲、安慰剂对照、多队列研究,包括队列1(包所有患者)和队列2(HRR基因突变的患者),该试验的主要终点为rPFS(影像学无进展生存期),次要终点为总生存期(OS)。
队列1共招募805名患者,随机分配为他拉唑帕利+恩杂鲁胺组和安慰剂+恩杂鲁胺组。通过对队列1的试验结果分析,他拉唑帕利+恩杂鲁胺未达到中位rPFS(影像学无进展生存期),安慰剂+恩杂鲁胺为21.9个月,该试验结果证明了与标准护理恩杂鲁胺作为患者的一线治疗相比,他拉唑帕利+恩杂鲁胺导致rPFS(影像学无进展生存期)具有临床意义和统计显著性改善。
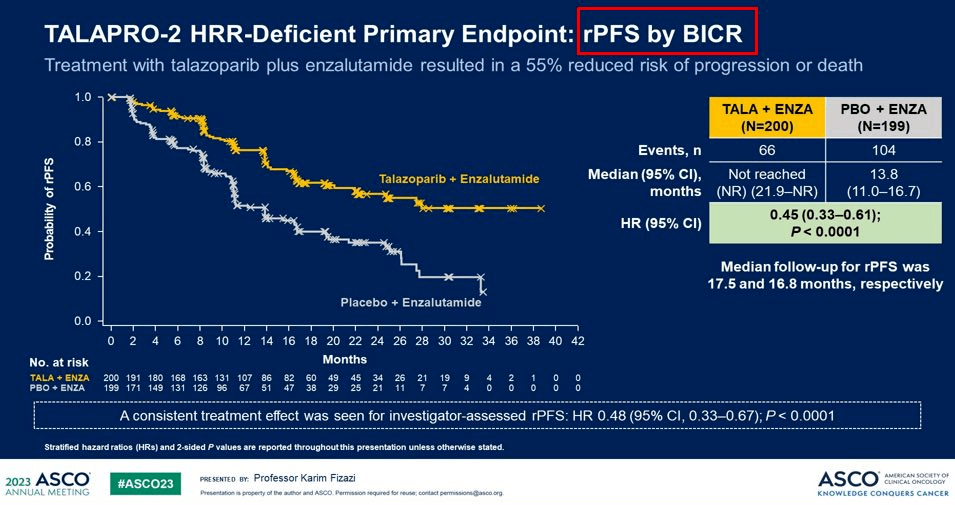
基于上述结果又开启了队列2的研究,队列2招募399名患者,这 399 名患者以1:1的方式随机分配到他拉唑帕利+恩杂鲁胺组和安慰剂+恩杂鲁胺组,治疗一直持续到疾病进展或毒性无法耐受。研究结果显示:与单独使用恩杂鲁胺相比,恩杂鲁胺+他拉唑帕利显著改善了影像学无进展生存期(rPFS)。他拉唑帕利+恩杂鲁胺尚未达到中位rPFS(影像学无进展生存期),而单独使用恩杂鲁胺为13.8个月。(见下图)
在安全性方面,与每种药物的已知安全性特征基本一致。30%接受他拉唑帕利联合治疗的患者发生严重不良反应,>2%的患者报告的严重不良反应包括贫血和骨折。
目前在中国,辉瑞正在开展多项恩杂鲁胺联合他拉唑帕利治疗前列腺癌的临床试验,相信在不久的将来,中国也会引进该疗法,造福更多中国患者。
 恩杂鲁胺(enzalutamide)
恩杂鲁胺(enzalutamide) 胶囊剂
40mg*112粒|40mg*16*7粒
 日本安斯泰来
日本安斯泰来
去势抵抗性前列腺癌患者;转移性去势敏感型前列腺癌患者以及非转移性去势敏感型前列腺癌(nmCSPC),具有高转移风险的生化复发的患者。
2025-10-02 09:06:30
2025-10-02 08:59:26
2025-10-02 08:53:33
2025-10-02 08:46:52
2025-10-02 08:43:01
2025-10-02 08:39:03
2025-10-02 08:29:52
2025-10-02 08:23:10
2025-06-16 16:15:01
2025-06-16 16:06:49