

中国第1个提交新药上市申请的自主开发的抗体-药物偶联物。维迪西妥单抗以肿瘤表面的HER2蛋白为靶点,能精准识别癌细胞并与之结合,穿透细胞膜进入其内部,从而杀死癌细胞。
 荣昌生物
荣昌生物  用法用量
用法用量 副作用
副作用  注意事项
注意事项  适应症
适应症  药物相互作用
药物相互作用 活性成份:维迪西妥单抗是一种抗体药物偶联剂,药物结构包括三部分: (1) 抗人表皮生长因子受体2胞外区(HER2 ECD)抗体(2)连接子(MC-Val-Cit-PAB, Linker ) (3)细胞毒素单甲基澳瑞他汀E (Monomethyl Auristatin E, MMAE)。
辅料:盐酸组氨酸、甘露醇、蔗糖、聚山梨酯80.氢氧化钠。
本品为白色至淡黄色疏松体,复溶后为无色至淡黄色澄明液体。
本晶适用于至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)的患者,HER2 过表达定义为HER2免疫组织化学检查结果为2+或3+。
本品应由在抗肿瘤治疗方面富有经验的医生处方使用。
接受本品治疗的患者应确认为HER2过表达肿瘤,HER2过表达定义为免疫组化(IHC)评分为2+或3+。
该检测必须在专业实验室进行,以确保结果的可靠性。
有关检测性能和解释的完整说明,请参阅相关HER2检测分析说明书。
2.5 mg/kg,每两周-次,静脉滴注(禁止静脉推注或快速静注给药)。
给药方式为静脉滴注,禁止静脉推注或快速静注给药。
历时30-90 分钟(通常建议60分钟左右)。
滴注期间,如发生滴注相关反应或超敏性反应,减慢或中断滴注,和/或给予适当医学治疗。
对危及生命的滴注相关反应立即停止用药。
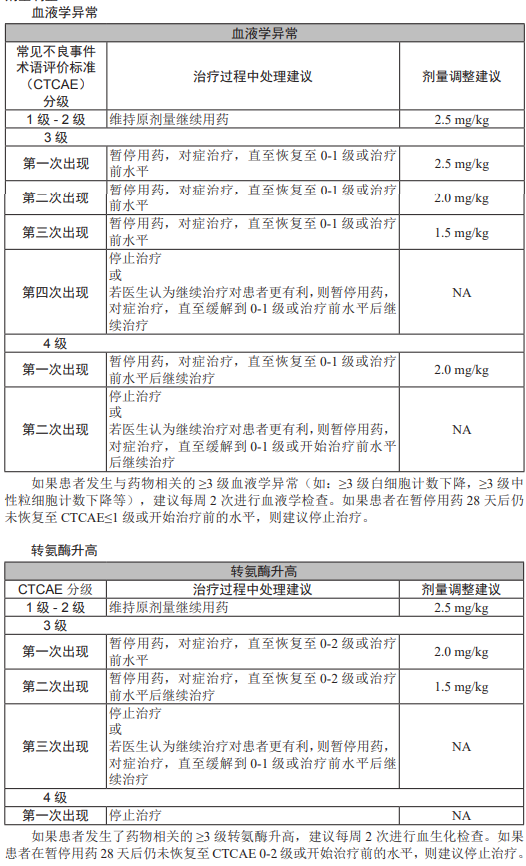
常见的实验室检查类不良反应包括血液学异常(白细胞计数降低、中性粒细胞计数降低)、转氨酶(天门冬氨酸氨基转移酶、丙氨酸氨基转移酶)升高。
常见的临床症状、体征类不良反应包括脱发、乏力、感觉减退等。
于2-8C避光保存和运输。
接受本品治疗的患者,常出现以粒细胞减少为特征的血液学异常。
350 例患者中的血液学不良反应包括: 55.4% 的患者出现过白细胞计数降低(其中109%为23级),50.6%的患者出现过中性粒细胞计数降低(其中16.9%为23级),16.0% 的患者出现过血小板降低(其中1.1%为23级),12.0% 的患者出现过血红蛋白降低(其中1.1%为23级)。
在每次接受本品治疗之前,或有临床指征时,应当监测患者血常规。
出现血液学异常时,应当根据血液学异常的程度进行剂量调整、给予对症治疗。
剂量调整方法参考[用法用量]章节。
接受本品治疗的患者,常出现转氨酶升高。
350 例患者中,49.7% 的患者出现过与药物相关的天门冬氨酸氨基转移酶升高(其中2.6%为23级),42.9%的患者出现过与药物相关的丙氨酸氨基转移酶升高(其中1.7%为≥3级)
在每次接受本品治疗之前,或有临床指征时,应当监测患者的肝功能指标。
出现转氨酶升高时,应当根据其程度进行剂量调整.给予对症治疗。
剂量调整方法参考[用法用量]章节。
与本品相关的感觉异常主要表现为感觉减退(麻木),部位多见于手、足。
350例忠者中,40.9%的患者出现过与药物相关的感觉减退,8.9% 为≥3级。
治疗期间应当监测患者是否有新发或加重的感觉异常症状和体征,并根据神经毒性的程度进行剂量调整、给予对症治疗。
剂量调整方法参考[用法用量]章节。
必要时应当请神经专科医生进行签别诊断和治疗。
基于动物试验结果,本品可能对男性生殖系统、胚胎-胎儿发有具有潜在毒性。
女性患者在开始接受本品治疗前,应当进行妊娠检查。
建议有生育可能的女性患者在治疗过程中以及治疗结束后的至少180天内,使用适当的方法避孕。
建议配偶有生育可能的男性忠者在治疗过程中以及治疗结束后的至少180天内,使用适当的方法避孕。
尚未确立:本品在妊娠妇女中的安全性和有效性。
应建议育龄期妇女或男性患者的配偶,在接受本品治疗期间应当避免怀孕。
如果在怀孕期间使用这种药物,或者使用这种药物期间怀孕,那么医生应告知患者这对胎儿的潜在危害。
在治疗过程中以及治疗结束后的至少180天内,应该使用适当的方法避孕。
尚未明确本品及其代谢产物是否经人乳排出。
尚未确立本品在18岁以下儿童及青少年中的安全性和有效性。
在350例接受本品治疗的患者中,有77人(22%)≥65岁。
这些患者的有效性和安全性与整体人群相比未见明显差异。
(以上信息来源于中国药监局药品说明书)
本品应由在抗肿瘤治疗方面富有经验的医生处方使用。
接受本品治疗的患者应确认为HER2过表达肿瘤,HER2过表达定义为免疫组化(IHC)评分为2+或3+。
该检测必须在专业实验室进行,以确保结果的可靠性。
有关检测性能和解释的完整说明,请参阅相关HER2检测分析说明书。
2.5 mg/kg,每两周-次,静脉滴注(禁止静脉推注或快速静注给药)。
给药方式为静脉滴注,禁止静脉推注或快速静注给药。
历时30-90 分钟(通常建议60分钟左右)。
滴注期间,如发生滴注相关反应或超敏性反应,减慢或中断滴注,和/或给予适当医学治疗。
对危及生命的滴注相关反应立即停止用药。

常见的实验室检查类不良反应包括血液学异常(白细胞计数降低、中性粒细胞计数降低)、转氨酶(天门冬氨酸氨基转移酶、丙氨酸氨基转移酶)升高。
常见的临床症状、体征类不良反应包括脱发、乏力、感觉减退等。
接受本品治疗的患者,常出现以粒细胞减少为特征的血液学异常。
350 例患者中的血液学不良反应包括: 55.4% 的患者出现过白细胞计数降低(其中109%为23级),50.6%的患者出现过中性粒细胞计数降低(其中16.9%为23级),16.0% 的患者出现过血小板降低(其中1.1%为23级),12.0% 的患者出现过血红蛋白降低(其中1.1%为23级)。
在每次接受本品治疗之前,或有临床指征时,应当监测患者血常规。
出现血液学异常时,应当根据血液学异常的程度进行剂量调整、给予对症治疗。
剂量调整方法参考[用法用量]章节。
接受本品治疗的患者,常出现转氨酶升高。
350 例患者中,49.7% 的患者出现过与药物相关的天门冬氨酸氨基转移酶升高(其中2.6%为23级),42.9%的患者出现过与药物相关的丙氨酸氨基转移酶升高(其中1.7%为≥3级)
在每次接受本品治疗之前,或有临床指征时,应当监测患者的肝功能指标。
出现转氨酶升高时,应当根据其程度进行剂量调整.给予对症治疗。
剂量调整方法参考[用法用量]章节。
与本品相关的感觉异常主要表现为感觉减退(麻木),部位多见于手、足。
350例忠者中,40.9%的患者出现过与药物相关的感觉减退,8.9% 为≥3级。
治疗期间应当监测患者是否有新发或加重的感觉异常症状和体征,并根据神经毒性的程度进行剂量调整、给予对症治疗。
剂量调整方法参考[用法用量]章节。
必要时应当请神经专科医生进行签别诊断和治疗。
基于动物试验结果,本品可能对男性生殖系统、胚胎-胎儿发有具有潜在毒性。
女性患者在开始接受本品治疗前,应当进行妊娠检查。
建议有生育可能的女性患者在治疗过程中以及治疗结束后的至少180天内,使用适当的方法避孕。
建议配偶有生育可能的男性忠者在治疗过程中以及治疗结束后的至少180天内,使用适当的方法避孕。
尚未确立:本品在妊娠妇女中的安全性和有效性。
应建议育龄期妇女或男性患者的配偶,在接受本品治疗期间应当避免怀孕。
如果在怀孕期间使用这种药物,或者使用这种药物期间怀孕,那么医生应告知患者这对胎儿的潜在危害。
在治疗过程中以及治疗结束后的至少180天内,应该使用适当的方法避孕。
尚未明确本品及其代谢产物是否经人乳排出。
尚未确立本品在18岁以下儿童及青少年中的安全性和有效性。
在350例接受本品治疗的患者中,有77人(22%)≥65岁。
这些患者的有效性和安全性与整体人群相比未见明显差异。
(以上信息来源于中国药监局药品说明书)
本晶适用于至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)的患者,HER2 过表达定义为HER2免疫组织化学检查结果为2+或3+。


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药



药学专业 对传染性疾病的研究


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


药学专业 对传染性疾病的研究



药学专业 对传染性疾病的研究



药学专业 对传染性疾病的研究



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药


 在线咨询
在线咨询