摘要:抗体偶联药|DS-8201、维迪西妥单抗治疗HER2阳性胃癌
近日,#男子每晚熬夜到3点查出胃癌#这一热搜话题引发热议,同时也让大家意识到一个严峻的问题:胃癌越来越年轻化了。近几年35岁以下患胃癌的青年人不在少数,不仅如此,低年龄胃癌患者的肿瘤学特性呈现出恶性程度高、进展快等特点,处理起来往往比中老年患者更加棘手。纵观我国的胃癌治疗进展,尽管靶向治疗、免疫治疗等多种手段延长了患者生存期,但胃癌的转移复发率仍然很高,效果仍不尽人意,抗体偶联药物(ADC)的出现打破了这个僵局。
抗体偶联药物(ADC)是一类由单克隆抗体通过连接子与细胞毒类药物连接而成的抗肿瘤药物,兼具靶向药物的优点和小分子化疗药物强大的杀伤力,疗效更好、副作用更小,是癌症治疗的热门研究领域[1]。
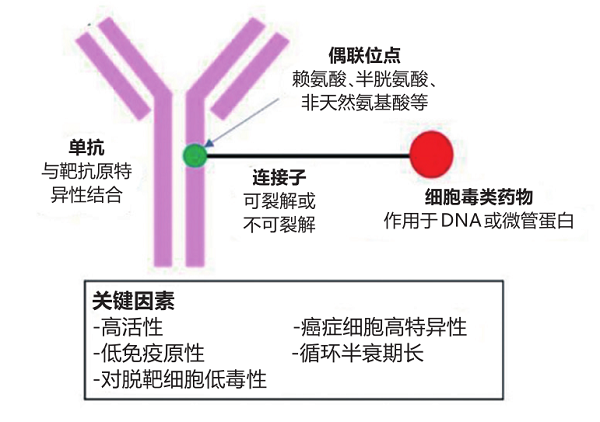
我们可以把抗体偶联药物想象成一列只有车头和1节车厢的火车:车头装有能精准识别某些癌细胞的“精准定位系统”(特异性抗体),车厢装满用来消灭癌细胞的“弹药”(细胞毒性药物),而车头和车厢之间用一种被称为“连接子”的结构相连。开始用药后,抗体偶联药物就会沿着人体的血液循环系统将细胞毒性药物送往目标癌细胞,然后和癌细胞紧密结合,最终将癌细胞杀死。
目前国内外已有多种抗体偶联药物广泛应用于临床,在胃癌治疗中的成就尤其引人注目。
根据抗体偶联药物的作用机制,准确识别癌细胞表面的特异性抗原是精准发挥药效的前提,因此靶点的选择十分重要。理想的靶点需要在肿瘤细胞中过表达,而在其他正常细胞表面表达很少或者不表达。人类表皮生长因子受体2(HER2)就是这样的靶点,15%-25%的胃癌患者为HER2阳性,因此它成为很多抗体偶联药物的选择[2]。
针对胃癌的治疗,到目前为止国内外共2款HER2靶向抗体偶联药物获批上市,分别为DS-8201(Enhertu)和维迪西妥单抗。
2021年1月15日,阿斯利康和第一三共制药合作开发的HER2靶向抗体偶联药物DS-8201(fam-trastuzumab deruxtecan,T-DXd,Enhertu)获得美国食品和药品监督管理局(FDA)批准,用于既往接受过曲妥珠单抗的局部晚期或转移性HER2阳性胃或胃食管交界处腺癌患者的治疗。这是DS-8201获批的第二项适应症,首次获得美国药监局批准是在2019年12月,用于HER2阳性不可切除或转移性乳腺癌的治疗。
试验设计
该适应症的批准是基于2期DESTINY-Gastric01试验的结果,这是一项开放标签、多中心、随机试验,旨在评估DS-8201对HER2阳性胃癌或胃食管交界处腺癌患者的三线或后线治疗效果。
试验共入组187例(包括日本149例)HER2阳性晚期胃癌或胃食管交界腺癌患者,这些患者先前接受过2种或多种方案(包括5-FU、含铂化疗、曲妥珠单抗)后疾病进展。研究中,患者按2:1的比例随机分为两组,一组接受DS-8201(6.4mg/kg)治疗,另一组接受化疗(紫杉醇或伊立替康单药治疗),每三周一次[4]。
疗效结果
与化疗组相比,DS-8201治疗组在客观缓解率(ORR)和总生存期(OS)方面有显著改善:
在175例可评估患者中,DS-8201治疗组的客观缓解率为51.3%,而化疗组为14.3%;
DS-8201组的中位总生存期为12.5个月,而化疗组为8.4个月;
DS-8201组与化疗组相比,死亡风险降低了41%。
安全性结果
DS-8201的安全性和耐受性与先前试验中的结果一致,未发现新的不良反应,且不良反应发生率未显著增加。在接受DS-8201治疗的125例患者中,尽管有122例(97.6%)出现药物相关不良反应,但多数为轻度,安全性基本可控。
最常见的不良反应为白细胞减少、恶心、食欲下降、贫血、血小板减少、乏力、腹泻、脱发、呕吐等。
总体而言,针对HER2阳性胃癌或胃食管交界处腺癌患者,DS-8201疗效显著,且安全性可耐受。
2021年底,阿斯利康和第一三共(中国)与海南博鳌乐城国际医疗旅游先行区管理局签署了合作协议,三方将推动肿瘤创新药物包括靶向HER2的抗体偶联药物DS8201等多个急需进口用药的合作试点,加速全球创新肿瘤药物引入中国[3]。
2022年3月3日,首位中国HER2阳性乳腺癌患者顺利开展用药,这是DS-8201在国内的首次临床应用,为中国肿瘤患者带来了新的希望。
2022年3月21日,DS-8201在中国的上市申请获得了国家药监局受理,随后该申请被纳入优先审评名单。该药物的研发公司第一三共计划2023年下半年之前取得批准并开始在中国销售,相信不久的将来必能惠及国内患者!
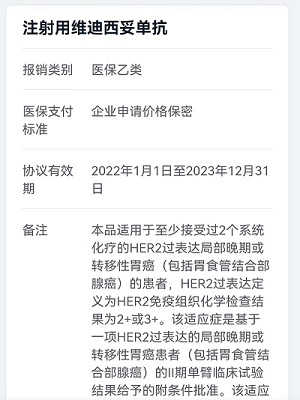
2021年6月9日,荣昌生物自主研发的注射用维迪西妥单抗(Disitamab Vedotin,商品名:爱地希®)获得我国药监局(NMPA)批准上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。同时它也是首个国产抗体偶联药物药物,意义重大。

试验设计
2020年ASCO大会上公布了一项维迪西妥单抗治疗HER2过表达局部晚期或转移性胃癌的2期试验结果(NCT03556345)。这是一项开放标签、多中心、单臂试验,研究共纳入127例既往接受过2线或2线以上系统化疗的HER2过表达晚期胃癌(包括胃食管结合部腺癌)患者。
疗效结果
维迪西妥单抗治疗的患者客观缓解率(ORR)为24.4%,中位无进展生存期(PFS)为4.1个月,中位总生存期(OS)为7.9个月。
安全性结果
常见的不良反应为:白细胞计数降低、脱发、中性粒细胞计数降低等,以轻中度为主,不良反应基本可控。
值得注意的是,荣昌生物在美国提交了维迪西妥单抗治疗晚期或转移性胃癌以及胃食管结合部腺癌的临床试验申请,该申请已经于2020年11月获得了美国药监局(FDA)许可,同时美国药监局还授予了维迪西妥单抗在胃癌适应症开发上的快速通道资格,以加快惠及更多胃癌患者。
2021年12月,注射用维迪西妥单抗上市半年后被纳入国家医保乙类目录,有效期为2022年1月1日至2023年12月31日。这对于患者来说是一个好消息,为他们带来了新的治疗选择。据了解,维迪西妥单抗的医保价格为3800元/支(60mg/支),由于各地医保报销比例不同,具体情况有需要可咨询当地医保局。
2022年4月20日,荣昌生物宣布,维迪西妥单抗联合泰它西普治疗胃癌的临床试验申请获得了国家监局批准,即将启动Ⅰ期临床试验,如果试验能产生积极结果,将会成为国产药品在胃癌治疗中的又一项重要临床进展。
这是一项单中心、开放性、剂量递增的1期临床试验,旨在评估维迪西妥单抗联合泰它西普在HER2表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者中的疗效和安全性。该研究的后续进展我将会持续追踪,期待维迪西妥单抗能带给我们更多惊喜!
虽然目前胃癌的治疗现状不容乐观,但抗体偶联药物的发展给胃癌患者带来了新的希望。我们有理由相信,随着研究不断开展,抗体偶联药物的临床价值也会更加凸显,必然能使越来越多的患者受益!
 维迪西妥单抗
维迪西妥单抗 注射剂
60mg/支
 荣昌生物
荣昌生物
中国第1个提交新药上市申请的自主开发的抗体-药物偶联物。维迪西妥单抗以肿瘤表面的HER2蛋白为靶点,能精准识别癌细胞并与之结合,穿透细胞膜进入其内部,从而杀死癌细胞。
2025-10-01 18:01:43
2025-10-01 17:53:46
2025-10-01 17:19:20
2025-10-01 17:13:44
2025-10-01 17:05:17
2025-10-01 17:00:56
2025-10-01 16:47:52
2025-10-01 16:22:20
2025-05-22 14:49:28
2025-05-22 14:39:38