摘要:多发性骨髓瘤联合疗法!塞利尼索联用总缓解率达76%!
多发性骨髓瘤(MM)是由骨髓浆细胞分化而来的恶性浆细胞瘤,发病机制尚不清楚,临床表现为骨髓浆细胞异常增生伴有单克隆免疫球蛋白 (M蛋白)过度生成。据 WHO统计,2020年中国有超过2.1万例新病例和近1.62万例多发性骨髓瘤导致的死亡病例。目前多发性骨髓瘤是一个无法治愈的疾病,任何的治疗方法都无法将克隆性浆细胞消灭,复发是每一位患者都会经历的过程(1)。
对于复发或难治性多发性骨髓瘤,有以下治疗方案:
1、根据复发程度,可选择继续进行化疗,依据前期治疗选择二线的治疗方案,或采用一些新的免疫力治疗的药物、蛋白酶体抑制剂等
2、通过自体,甚至异体的造血干细胞移植来进行治疗,控制病情,缓解复发程度
3、参与药物临床试验,如免疫细胞治疗的CAR-T细胞临床试验等,有较好的疗效(2)
塞利尼索联合硼替佐米、地塞米松或塞利尼索单纯联合地塞米松治疗多发性骨髓瘤都属于第一种治疗方案,那么,塞利尼索为什么可以治疗难治性多发性骨髓瘤呢?
塞利尼索是由Karyopharm Theraps研发的靶向药,2019年经美国FDA批准在美国上市,获批适应症如下:
(1)多发性骨髓瘤
①塞利尼索联合硼替佐米和地塞米松适用于既往至少接受过一种治疗的成年多发性骨髓瘤患者
②塞利尼索联合地塞米松适用于治疗复发或难治性多发性骨髓瘤的成人患者,这些患者至少接受过四种先前的治疗,并且对至少两种蛋白酶体抑制剂、至少两种免疫调节剂和一种抗cd38单克隆抗体难治性
(2)弥漫性大B细胞淋巴瘤
塞利尼索适用于治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的成年患者,包括由滤泡性淋巴瘤引起的至少经过二线系统治疗的弥漫性大B细胞淋巴瘤
并且由于适应症和疗效,获得了美国FDA认证的优先审查权和孤儿药称号,在2022年7月份,塞利尼索也通过了中国国家药品监督管理局的批准上市,并且已经进入了医保。
塞利尼索通过阻断导出蛋白1(XPO1)可逆地抑制肿瘤抑制蛋白(TSPs)、生长调节因子和致癌蛋白mRNA的核导出。塞利尼索抑制XPO1可导致TSPs在细胞核中积累,并减少多种肿瘤蛋白,如c-myc和细胞周期蛋白D1,抑制细胞周期,促进癌细胞凋亡。塞利尼索与地塞米松或硼替佐米联用在体外多发性骨髓瘤中显示出协同的细胞毒性作用,在体内小鼠异种移植多发性骨髓瘤模型(包括对蛋白酶体抑制剂耐药的模型)中增强了抗肿瘤活性。因此可以说,塞利尼索通过靶向XPO1来达到治疗疾病的目的。

接下来就是大家比较关心的问题之一,塞利尼索2023年的价格如何?
塞利尼索已经进入2023年的医保,医保后:
规格为20mg*12片 价格为22434.5元
不过由于各地的医保政策不同,每个人的报销比例也不同,因此这个价格仅供参考,具体的价格还请咨询当地的医保部门哦~即使进入了医保,这个价格对于大多数家庭还是有点昂贵的,因此可以选择和原研药效果基本相同的仿制药,但是价格会实惠很多,小编检索到的目前市场上流通的塞利尼索仿制药有两种:
(1)孟加拉珠峰 塞利尼索
规格为20mg*16片 价格约为3400元一盒
(2)老挝南塔塞利尼索
20mg*16粒 价格约为3000元一盒
由于这些药物都是国外药厂直发,因此价格会受到汇率浮动的影响。聊完价格,来到我们文章的重点,塞利尼索联合治疗复发难治性多发性骨髓瘤疗效如何?
在塞利尼索基本信息界面,我们可以了解到,塞利尼索联用治疗多发性骨髓瘤有两种治疗方案,因此塞利尼索的疗效也是在两个试验中得到证实的。
BOSTON(NCT03110562)对塞利尼索联合硼替佐米和地塞米松的疗效进行了评估,BOSTON是一项全球性、随机、开放标签、主动对照试验,研究对象为既往接受过1至3种抗多发性骨髓瘤方案治疗的成年患者。试验组接受塞利尼索联合硼替佐米和地塞米松的治疗,对照组接受硼替佐米和地塞米松的治疗。试验疗效基于国际骨髓瘤工作组(IMWG)多发性骨髓瘤统一反应标准的无进展生存期(PFS),由独立审查委员会(IRC)评估。试验结果显示:
1、中位无进展生存期:塞利尼索联合硼替佐米和地塞米松组为13.9个月,但对照组(硼替佐米和地塞米松)为9.5个月,值得注意的是,截止到随访结束,实验组仍有患者疾病没有出现进展,疗效显著。
2、总缓解率:塞利尼索联合硼替佐米和地塞米松组为76.4%,其中包括44.6%的非常好的缓解情况;对照组(硼替佐米和地塞米松)为62.3%,包括32.4%的非常好的缓解情况。
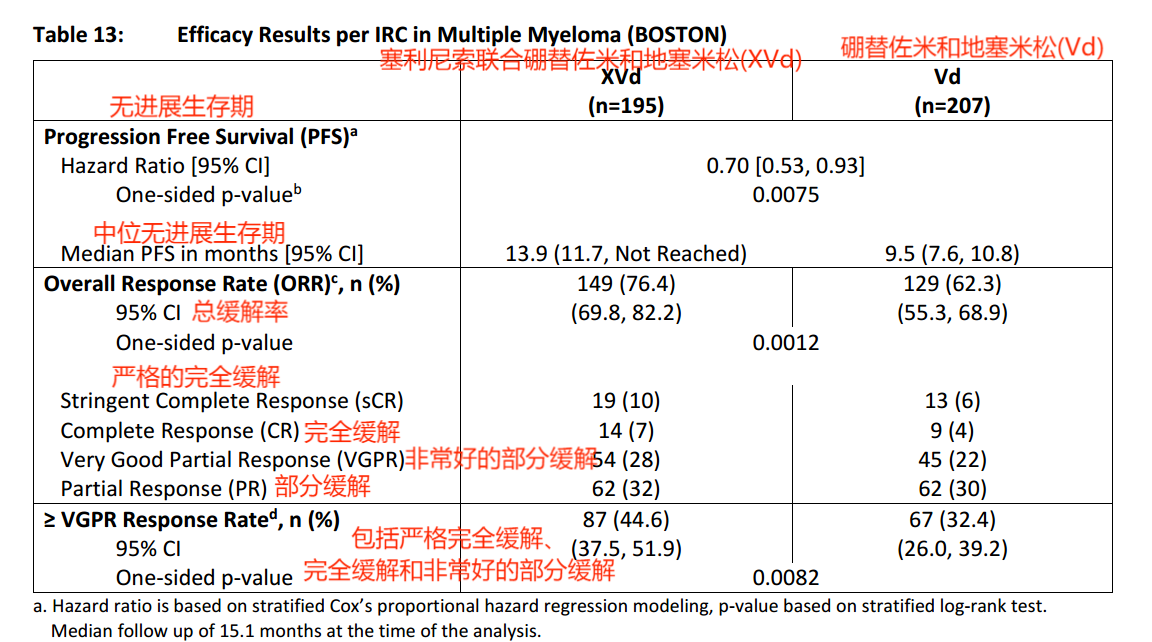
以上结果表明,塞利尼索联合硼替佐米和地塞米松治疗复发或者难治性多发性骨髓瘤相比于硼替佐米和地塞米松各个试验指标都好,表明塞利尼索联合硼替佐米和地塞米松治疗复发或者难治性多发性骨髓瘤疗效良好(3)。
STORM(NCT02336815)对塞利尼索联合地塞米松的疗效进行了评估。STORM是一项针对复发性或难治性多发性骨髓瘤(RRMM)成人患者的多中心、单臂、开放标签研究。STORM第2部分纳入了122例复发性或难治性多发性骨髓瘤患者,这些患者既往接受过3种或3种以上的抗骨髓瘤治疗方案,包括烷化剂、糖皮质激素、硼替佐米、卡非佐米、来那度胺、泊马度胺和抗CD38单克隆抗体;其骨髓瘤被证实对糖皮质激素、蛋白酶体抑制剂、免疫调节剂、抗CD38单克隆抗体和最后一种治疗方案难治。试验疗效基于总缓解率(ORR),由独立审查委员会(IRC)根据国际骨髓瘤工作组(IMWG)多发性骨髓瘤统一反应标准评估。试验结果显示:
总缓解率:塞利尼索联合地塞米松治疗复发性或难治性多发性骨髓瘤为25.3%
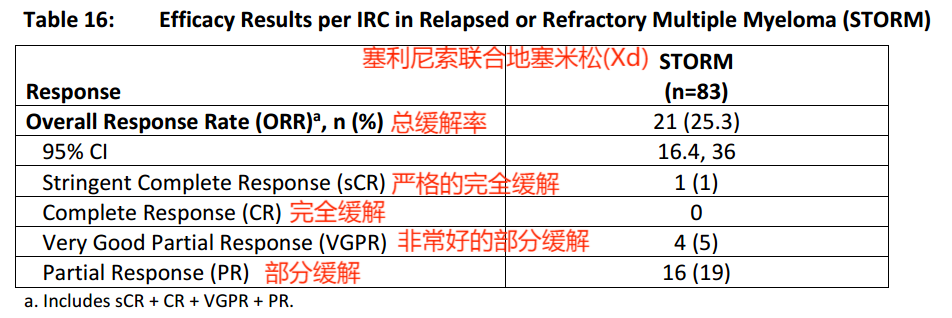
由于入组的患者之前接受了较多的治疗方案,因此塞利尼索联合地塞米松治疗复发性或难治性多发性骨髓瘤的结果被认为是有效的。
1、接受塞利尼索与硼替佐米和地塞米松联合使用(XVd)的多发性骨髓瘤患者
(1)最常见的不良反应(≥20%)是疲劳、恶心、食欲下降、腹泻、周围神经病变、上呼吸道感染、体重下降、白内障和呕吐
(2)3-4级实验室异常(≥10%)为血小板减少症、淋巴减少症、低磷血症、贫血、低钠血症和中性粒细胞减少症
2、接受塞利尼索与地塞米松联合使用(Xd)的多发性骨髓瘤患者
最常见的不良反应(≥20%)是血小板减少、疲劳、恶心、贫血、食欲下降、体重下降、腹泻、呕吐、低钠血症、中性粒细胞减少、白细胞减少、便秘、呼吸困难和上呼吸道感染
接受治疗的患者所获得的收益大于服药的不良反应,所以,塞利尼索联合治疗复发难治性多发性骨髓瘤安全性可耐受。
马军教授:目前美国国家综合癌症网络(NCCN)、欧洲血液学协会联合欧洲肿瘤内科学会(EHA-ESMO)、中国临床肿瘤学会(CSCO),以及中国多发性骨髓瘤诊治指南等国内外权威指南均将塞利尼索方案纳入复发性或难治性多发性骨髓瘤的指南推荐。而且,塞利尼索与地塞米松联合使用(Xd)方案已获得FDA和NMPA批准用于复发性或难治性多发性骨髓瘤患者的治疗。随着塞利尼索在中国的上市,用药可及性大大提高,有望惠及更多多发性骨髓瘤患者。

 塞利尼索
塞利尼索 片剂
20mg*16片
 老挝卢修斯
老挝卢修斯
是全球首款口服型XPO1(核输出蛋白)抑制剂。
2025-05-29 16:04:26
2025-05-29 15:58:39
2025-05-29 15:50:27
2025-05-29 15:46:49
2025-05-29 15:38:10
2022-06-06 17:28:10
2022-12-26 15:56:27
2023-09-08 10:10:34
2026-01-15 13:55:13
2026-01-15 13:47:42