摘要:目前,帕博利珠单抗已被国家药品监督管理局(NMPA)批准单药一线用于治疗PD-L1TPS1%的表皮生长因子受体(EGFR)突变阴性和间变性淋巴瘤激酶(ALK)重排阴性的局部晚期或转移性非小细胞肺癌。
近年来,免疫疗法和免疫检查点抑制剂的出现为非小细胞肺癌提供了新的治疗选择。帕博利珠单抗(KEYTRUDA,pembrolizumab)是一种抗程序性细胞死亡蛋白1(PD-1)的人源化IgG4单克隆抗体。KEYNOTE-042是一项多中心、随机、对照的Ⅲ期临床试验,其评估了帕博利珠单抗单药对比一线化疗方案治疗程序性细胞死亡蛋白配体1(PD-L1)表达阳性的局部晚期或转移性的非小细胞肺癌的疗效和安全性。
KEYNOTE-042(NCT02220894)对帕博利珠单抗的疗效进行了研究,这是一项随机、多中心、开放标签、主动对照试验,对1274名III期非小细胞肺癌患者进行了研究,这些患者不适合手术切除或确定性放化疗,也不适合转移性非小细胞肺癌患者。
随机分组按ECOG PS(0对1)、组织学(鳞状组织对非鳞状组织)、地理区域(东亚对非东亚)和PD-L1表达TPS(TPS肿瘤细胞阳性比例评分的缩写,是一种在免疫检查点抑制剂治疗之前进行的PD-L1表达水平检测的评价方法,通常情况下TPS评分越高,采用免疫检查点抑制剂治疗的疗效越好)进行分层≥50%与1-49%相比。患者随机(1:1)接受帕博利珠单抗 200mg静脉注射,每3周一次,或由研究人员选择以下含铂化疗方案之一:
培美曲塞500 mg/m2每3周一次,卡铂AUC 5至6 mg/mL/min每3周一次,在第1天最多6个周期,对于组织学无症状的患者,可选择培美曲塞500 mg/m2每3周一次紫杉醇200mg/m2每3周一次,卡铂AUC 5至6mg/mL/min每3周一次,第1天最多6个周期,对于组织学无症状的患者,可选择培美曲塞500mg/m2每3周一次。
帕博利珠单抗治疗持续到RECIST v1。1(修改为最多追踪10个靶病变,每个器官最多追踪5个靶病变)-定义疾病进展、不可接受的毒性或最多24个月。如果患者临床稳定,并根据研究者的判断获得临床益处,则允许在复发定义的疾病进展之外服用帕博利珠单抗。帕博利珠单抗治疗可以在随后的疾病进展时重新开始,并持续长达12个月。每9周进行一次肿瘤状态评估。主要疗效指标OS(总生存期),其他疗效指标为最多追踪10个靶病变,每个器官最多追踪5个靶病变。
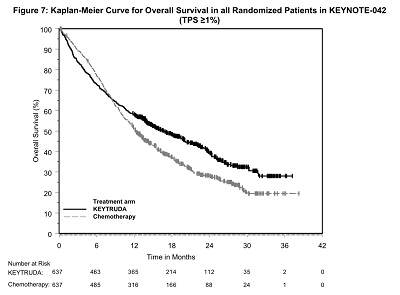
该试验结果显示,帕博利珠单抗与一线化疗方案相比,可显著延长患者的总生存(OS)时间,且不良反应较少;同时,对于PD-L1高表达[肿瘤细胞阳性比例分数(TPS)≥50%)]的患者,其OS时间的延长及临床获益更为显著,其中帕博利珠单抗组患者的中位OS时间为20.0个月[95%置信区间(95%CI)为15.4~24.9],一线化疗方案组患者的中位OS时间为12.2个月(95%CI为10.4~14.2)。
KEYNOTE-042中TPS≥1%的总生存期(OS)的Kaplan-Meier曲线分析如下图
目前,帕博利珠单抗已被国家药品监督管理局(NMPA)批准单药一线用于治疗PD-L1TPS≥1%的表皮生长因子受体(EGFR)突变阴性和间变性淋巴瘤激酶(ALK)重排阴性的局部晚期或转移性非小细胞肺癌。
 帕博利珠单抗
帕博利珠单抗 注射剂
100mg/4ml
 美国默沙东
美国默沙东
肝癌肺癌黑色素瘤等免疫检查点抑制剂,显著延长生存期
2025-10-31 16:07:13
2025-10-31 16:00:56
2025-10-31 11:32:04
2025-10-31 11:19:33
2025-10-31 11:06:29
2025-10-31 10:53:54
2025-10-31 10:45:37
2025-04-24 12:18:55
2025-02-12 13:30:09
2022-05-12 17:28:37