摘要:ESMO2022前沿:AMG 510联合帕尼单抗治疗结直肠癌
结直肠癌(Colorectal Cancer,CRC)是一种常见的胃肠道恶性肿瘤,全球每年有超过100万确诊病例,死亡率仅次于肺癌和乳腺癌。
目前晚期结直肠癌的治疗选择主要是靶向治疗,对于非KRAS突变的结直肠癌患者来说,帕尼单抗(Panitumumab,Vectibix)是广泛应用的治疗药物,它是一种人源化单克隆抗体,靶向EGFR,2006年获批用于治疗结直肠癌;但是对于KRAS突变的结直肠癌患者,研究表明帕尼单抗的疗效有所降低,生存期甚至比化疗方案更短,这部分患者急需新的治疗选择。
KRAS是结直肠癌中最常见的突变类型,KRAS G12C是KRAS突变的其中一种,存在于3%-5%的结直肠癌患者中。过去几十年间,一直没有针对KRAS突变的靶向药问世,直到2021年AMG 510获批上市才结束了KRAS突变无药可医的历史。
临床研究表明,AMG 510对于多种KRAS突变的实体瘤都有着出色的疗效,其中就包括结直肠癌,虽然目前还未获批适应症,但有希望成为KRAS G12C突变结直肠癌患者的救命药。
AMG 510(Sotorasib,Lumakras)是一种KRAS G12C突变抑制剂,可以选择性和不可逆地抑制KRAS G12C突变蛋白,这种抑制可导致活化的表皮生长因子受体(EGFR)蓄积,因此AMG 510与EGFR单抗联用可增强抗肿瘤疗效并抵消潜在的逃逸机制。
在刚刚结束的2022欧洲肿瘤学会年会(ESMO)中,发表了多项AMG 510和帕尼单抗联合使用治疗结直肠癌的前沿研究进展,本文对此进行汇总,以帮助患者了解最新信息。

早在2期CodeBreaK 100研究中,AMG 510作为单药治疗在重度预治的KRAS G12C突变结直肠癌(CRC)患者中表现出适度的临床活性,客观缓解率(ORR)达9.7%。
Ib期CodeBreaK 101剂量探索和扩展队列的早期数据显示,AMG 510与帕尼单抗联合治疗化疗难治性KRAS G12C突变转移性结直肠癌具有良好的抗肿瘤活性。
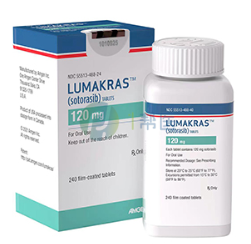
此次ESMO大会中, Kuboki教授报告了40例难治性转移性结直肠癌患者的剂量扩展队列的短期研究结果。
试验设计
CodeBreaK 101(NCT04185883)研究包含多个队列,难治性转移性结直肠癌队列的入组标准为既往接受氟嘧啶、奥沙利铂、伊立替康和抗血管生成药物治疗期间或治疗后进展的患者。
截至2022年3月25日,共有40例患者(75%为女性,中位年龄57.5岁)入组并接受AMG 510每日一次口服给药(960 mg)和帕尼单抗每2周一次给药(6 mg/kg,静脉注射)。
研究的主要终点是安全性;次要终点包括抗肿瘤活性、无进展生存期(PFS)、总生存期(OS)和药代动力学(PK)。
疗效结果
客观缓解率(ORR)为30%;疾病控制率为90%;在35例(87.5%)患者中观察到任何程度的肿瘤缩小。
安全性结果
37例(92.5%)患者发生了任何级别的治疗相关不良事件(TRAE),9例(22.5%)患者发生3级TRAE;分别有6例(15%)和8例(20%)患者与AMG 510和帕尼单抗相关;没有3级以上或导致治疗中止的TRAE报告。
总体来说,安全性结果与AMG 510和帕尼单抗的已知特征一致。
结论
该数据集进一步证明了AMG 510 +帕尼单抗联合治疗KRAS G12C突变转移性结直肠癌患者的安全性和耐受性,缓解率达到了既往AMG 510单药治疗的3倍,为进一步探索该联合治疗方案的应用提供了支持。
此外,Kuboki教授还表示,之后将公布随访时间更长的数据以及其他疗效数据,比如缓解持续时间、无进展生存期和总生存期等。
除了上述研究之外,还有更多研究正在进行中,未来的重点研究方向是将AMG 510+帕尼单抗的联合方案与标准治疗进行对比,以及探索该联合方案联合化疗的有效性。
上述提到的CodeBreaK 101试验已经表明,AMG 510和帕尼单抗联合治疗方案在化疗难治性转移性结直肠癌(mCRC)中显示出良好的抗肿瘤活性,随之而来的是一项对照研究—CodeBreaK 300。该研究目前正在进行中,Paez教授在本次ESMO大会中讲述了它的试验设计以及疗效评估标准。
CodeBreaK 300(NCT05198934)是一项全球、随机、开放性、3期对照研究,目的是在化疗难治性转移性结直肠癌患者中,评估AMG 510和帕尼单抗联合治疗是否优于标准治疗曲氟尿苷替匹嘧啶( Trifluridine/Tipiracil, TAS-102)或瑞戈非尼(Regorafenib)。
【(1)TAS-102是由日本研发的一种新型化疗药,适用于既往接受过氟嘧啶类、奥沙利铂和伊立替康为基础的化疗,以及既往接受过或不适合接受抗血管内皮生长因子治疗、抗表皮生长因子受体治疗的RAS野生型转移性结直肠癌患者。
(2)瑞戈非尼是一种小分子多激酶抑制剂,于2017年3月24日正式在我国上市,用于标准化疗失败后的转移性结直肠癌患者。】
试验设计
入组标准为经肿瘤活检证实携带KRAS G12C突变,且既往至少经过1线治疗,并且在氟尿嘧啶、伊立替康和奥沙利铂治疗期间或之后出现疾病进展或复发的转移性结直肠癌患者。
研究共纳入153例患者,并以1:1:1的比例随机分配到三个组中,第一组接受AMG 510(960 mg/天)和帕尼单抗;第二组接受AMG 510(240 mg/天)和帕尼单抗;第三组接受研究者选择的药物(曲氟尿苷替匹嘧啶或瑞戈非尼)。
该试验的主要终点是根据实体瘤疗效评价标准第1.1版(RECIST v1.1)评估的无进展生存期;关键次要终点包括总生存期和客观缓解率。
Paez教授表示,目前该研究进行到全球入组阶段,后续将持续跟进研究结果的发布,期待AMG 510+帕尼单抗这一联合方案带给我们更多惊喜。
CodeBreaK 101(NCT04185883)主方案是一项Ib期开放性研究,目的是在KRAS G12C突变的晚期实体瘤患者中评估多种基于AMG 510的联合治疗的疗效、安全性、耐受性、药代动力学(PK)。
CodeBreaK 101 研究的子方案包括转移性结直肠癌患者队列,目前正在评估AMG 510与帕尼单抗+化疗联用的疗效,该研究也进入到了全球入组阶段。
试验设计
该研究的入组标准为经证实携带KRAS G12C突变的转移性结直肠癌。
子方案为各队列的剂量探索和扩展研究,其中两项研究正在转移性结直肠癌患者中评估口服AMG 510联合帕尼单抗静脉注射+ FOLFIRI的疗效,分为两个队列:(1)既往未接受过治疗的患者队列;(2)既往接受过至少1种治疗的患者队列。
研究的主要终点是安全性,包括剂量限制性毒性和治疗期间出现治疗相关不良事件;次要终点包括疗效(客观缓解、疾病控制率、缓解持续时间、至缓解时间、无进展生存期和总生存期)和药代动力学参数。
2019年5月23日,AMG 510获得美国药监局(FDA)授予的孤儿药资格,用于KRAS G12C阳性结直肠癌。
此次ESMO会议中发表的多项研究又给予了我们极大的信心,相信未来AMG 510和帕尼单抗的联合方案一定能攻克难关,为KRAS突变结直肠癌患者带来新的生存希望。
 帕尼单抗(Vectibix)
帕尼单抗(Vectibix) 注射剂
20mg/ml|100mg/5mL/瓶
 美国安进
美国安进
适用于患有野生型RAS转移性结直肠癌(已扩散至结肠和直肠外部的癌症)的成人患者。
2023-09-13 11:22:04
2023-10-10 13:53:42
2023-10-10 14:12:35
2026-01-15 13:55:13
2026-01-15 13:47:42
2026-01-15 11:56:27
2026-01-15 11:40:40
2026-01-15 11:36:02
2026-01-14 20:52:28
2026-01-14 20:46:25