摘要:FDA批准的ADC药-恩美曲妥珠单抗、德喜曲妥珠单抗等
2013年起,美国食品药品监督管理局批准了4个ADC的6个适应症,这些 ADC的相关数据见下列,包括适应症及临床研究的特征性数据。
HER2+乳腺癌(HER2+)在乳腺癌中的比例高达15%-20%。近20年来,随着曲妥珠单抗(Trastuzumab)的联合化疗被证实可以延长患者的生存期(OS),大量的HER2靶向药物被批准上市。目前已有8种抗HER2的药物被美国FDA批准上市,包括单克隆抗体,酪氨酸激酶抑制剂(TKI),和ADC。
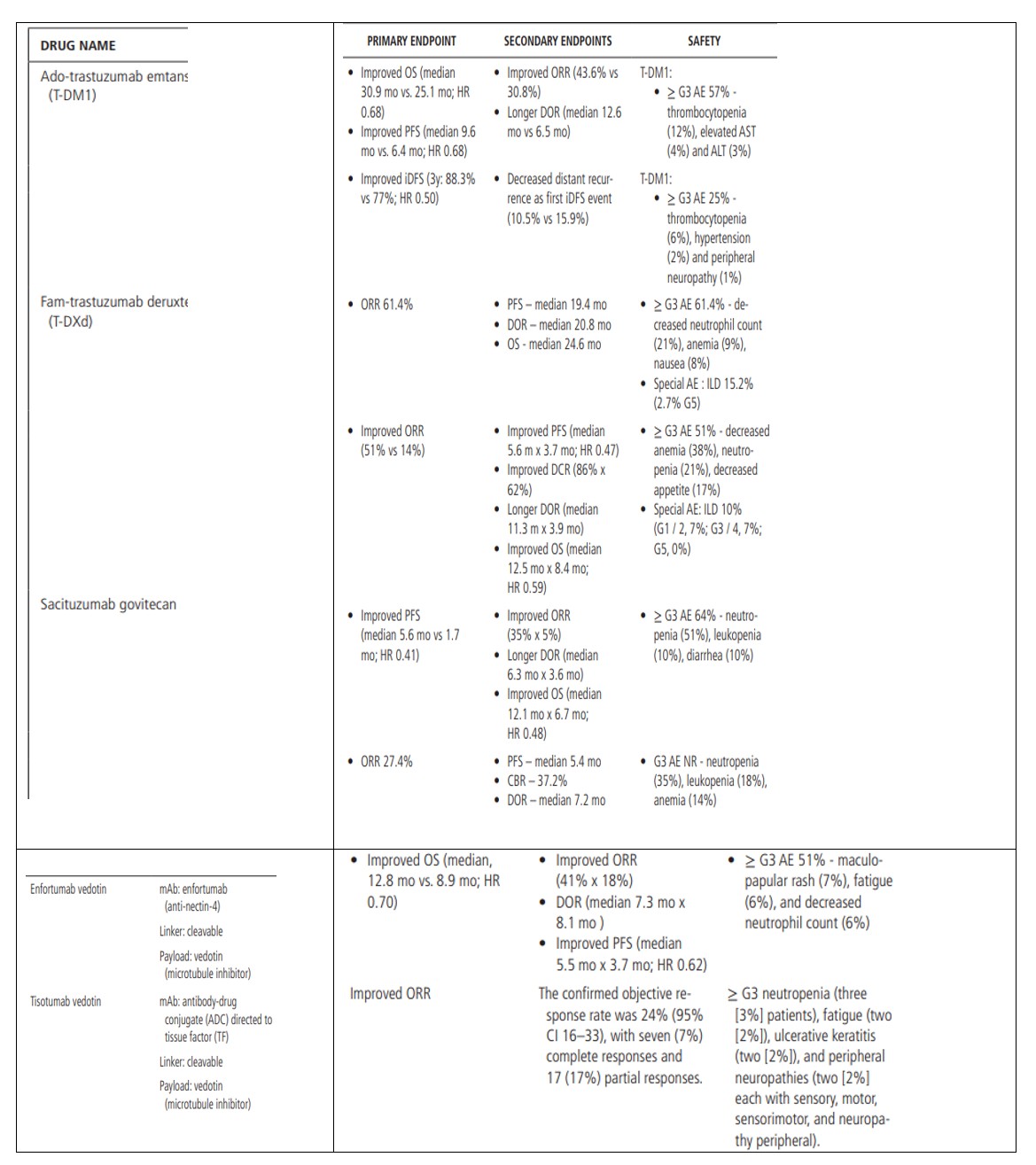
T-DM1是以曲妥珠单抗(Trastuzumab)为核心的ADC,其结构为连接子和DM1(细胞毒性药物)结合,药物与抗体的比例为3.5:1,是第一个被批准应用于实体肿瘤的抗肿瘤新药。2013年2月,该药因为EMILIA三期临床(ClinicalTrials,NCT00829166)的结果获得了FDA的批准。在那个时候,这个研究的结果就已经确定,T-DM1是HER2+乳腺癌的一种标准的二线疗法。需要指出的是,一线疗法的标准已经改变,目前包含双HER2阻滞,以及 曲妥珠单抗(Trastuzumab)和帕妥珠单抗(Patuzumab)联合紫杉醇(THP);但近期研究显示,T-DM1在一线THP化疗(使用盐酸吡柔比星治疗)后仍有较好的疗效。

2019年5月,经 KATHERINE临床研究(NCT01772472),T-DM1被首次应用于实体肿瘤的辅助化疗,是首个获批用于治疗实体瘤的ADC药物。在这个第三阶段的临床试验中,T-DM1可以改善非侵袭性的无病生存。3年内,无侵袭性无病生存率(88.3% vs77%),且未发现额外的不良反应。
德喜曲妥珠单抗(T-DXd)是以抗HER2单抗-曲妥珠单抗为靶点的新型ADC,有效药物为通过拓扑异构酶Ⅰ(TopotidaseⅠ)抑制效果的exatecan衍生物,药物与抗体的比例为8:1。2020年12月,美国食品药品监督管理局加快批准,对已使用过至少2种HER2抗体药物的HER2+转移性乳腺癌病人进行了5.4mg/kg,每 21 天一次的剂量的快速给药。在2 期 DESTINY-Breast01 的临床试验(NCT03248492)中有较好的疗效,T-DXd在T-DM1耐药株中表现出良好的抗肿瘤作用,这与T-DM1的特异性质密切相关。主要的生物化学变化有:药物与抗体的比值较T-DM1升高;负载对 Topo I的抑制,而对微管没有影响;和可能存在的“旁观者”效果。该现象是由于自由的细胞毒性的部分散布,从目标抗原阳性的细胞散布,从而使其具有对脱靶的癌细胞的杀伤活性的能力。“旁观者杀伤”效果与负载的膜渗透率及结合部的性质有关。该作用是一种新的 ADC的主要特点,也是多种癌症中常见的抗原不均一的原因。
结果证实T-DXd在无进展生存期(主要终点:中位,未达到VS 6.8个月)和客观缓解率(79.7% VS 34.2%;完全缓解率,16.1% VS 8.7%)方面明显好于T-DM1,且有出现总生存期提高趋势(12个月总生存率,94.1% VS 85.9%)。间质性肺病(ILD)是导致 T-DXd 停药的最常见的不良事件(AE),目前尚无4、5级 间质性肺病(ILD)事件的大规模临床试验,提示对T-DXd进行低剂量预处理,能否有效降低T-DXd对肺脏的危害。本研究将为T-DM1作为HER2+乳腺癌的靶向药物提供理论依据,也为进展为THP的临床转化提供新的思路。
HER2在约20%的转移性胃癌中呈异常高表达,且多见于胃-肠-食管结合部。与HER2+乳腺癌相似, 曲妥珠单抗(Trastuzumab)联合化疗可以改善在有转移的一线患者的生存。但是,相对于乳腺癌,HER2双靶点抑制剂对患者的生存期无明显改善。将抑制HER2的药物加入(新的)辅助疗法。
目前,以HER2为靶点的抗肿瘤药物尚无报道。但是,一项开放,随机,二期DESTINY-Gastric01临床研究(NCT03329690, ClinicalTrials,2期)的研究成果为我们提供了希望。T-DXd与标准治疗比较,12个月的随访期中位总生存期显著延长(12.5个月 VS 8.4个月)。我们前期研究发现,HER2 IHC分数3+组的客观缓解率较 IHC分数2+组(58% VS 29%)高。在此基础上,美国食品药品监督管理局在2021年1月批准了T-DXd治疗HER2+胃癌的临床试验。额外随访后(中位数随访时间,18个月),最终总生存期在2021年美国临床肿瘤学会年会上公布,T-DXd的益处得以维持(中位总生存期,12.5个月 VS 8.9个月)。应该指出,DESTINY-Gastric01实验也包括两个单独的、具有HER2低表达(IHC分数为1+或2+且FISH结果为阴性)的病人;我们将在下文中对这些队列的结果进行进一步的探讨。
转移性三阴乳腺癌(TNBC)的预处理效果不佳,目前以化疗为主的化疗方案仍是TNBC的首选方案。戈沙妥珠单抗(Sacituzumab govitecan)是一种以Trop-2为靶点的新型ADC,它是一种新型的、具有抗Trop2抗体的ADC,被认为是一种具有潜在临床应用价值的新型药物,它被广泛应用于临床,由与细胞毒剂SN-38连接的抗滋养层细胞表面抗原2(Trop-2)抗体构建而成,SN-38是拓扑异构酶I抑制剂伊立替康的活性代谢物。Trop-2作为一种钙离子感受器,在多种癌症包括乳腺癌(>90%)中均有表达。在多个不同的细胞系中,Trop-2的高表达可以促进肿瘤的增长,而Trop-2在细胞系中的高表达与乳腺癌患者的不良预后密切相关。与T-DXd相似,戈沙妥珠单抗(sacituzumab govitecan)通过一种能穿透细胞膜、产生旁观者效应的药物分子,通过水解连接分子将药物从肿瘤组织中释放出来。
2020年4月,美国食品药品监督管理局(FDA)加速批准戈沙妥珠单抗用于已接受≥2种既往转移性疾病治疗的转移性三阴性乳腺癌(TNBC)的治疗,在1/2期临床试验中,客观缓解率达33.3%。2021年4月,美国FDA通过一项3期临床试验(NCT02574455),批准戈沙妥珠单抗作为一种新的抗肿瘤药物用于治疗至少接受≥2次既往全身治疗(至少有一处转移)的患者。
目前临床(一线、二线和维持治疗)主要采用铂类药物及抗PD-1/抗PD-L1小分子抑制剂。另外,近期又有2个药物获批上市:恩诺单抗(Enfortumab Vedotin)和 戈沙妥珠单抗(Sacituzumab Govitecan)。恩诺单抗(Enfortumab Vedotin)为 ADCs,其靶向作用于 mUC组织的nectin-4。与T-DXd、戈沙妥珠单抗(Sacituzumab Govitecan)相似,前期的研究也提示了恩诺单抗(Enfortumab Vedotin)可以在旁观者中引起对抗原阴性的细胞的杀伤作用。2019年12月,美国 FDA加速批准恩诺单抗(Enfortumab Vedotin)基于在二期临床试验中取得的良好的临床效果,并对其进行了临床试验。之后,美国食品药品监督管理局将快速审批改为例行审批,EV-301(NCT03474107)的确证试验取得了良好的效果。本项目拟在前期EV-301的基础上,进一步开展二期EV-202的临床试验(NCT04225117),对nectin-4在乳腺、肺部、头颈及胃癌等多种肿瘤中的作用进行深入研究。

2021年4月,因为 FDA 加速批准了戈沙妥珠单抗治疗尿路上皮癌(mUC),mUC成为全球第二个被临床应用的 ADC的实体恶性肿瘤。与乳腺癌等多种肿瘤相似, mUC中Trop-2显著高表达,且与肿瘤发生发展密切相关,是研究 mUC中Trop-2调控机制的理想靶点。TROPHY-U-01临床研究(NCT03547973)共纳入113例接受铂类化疗和抗 PD-1/抗 PD-L1 治疗后出现进展的Trop-2型尿路上皮癌病人,中位随访期9.1个月中,中位无进展生存期为5.4个月,其中77%的病人有较好的疗效。临床研究表明,3级及以上的不良反应主要是嗜酸性粒细胞减少(35%),白细胞减少(18%),贫血(14%),腹泻(10%)。
2021年9月,美国食品药品监督管理局(FDA)加速审批替索单抗(Tisotumab Vedotin)作为一种新型的肿瘤靶向治疗药物,用于化疗期间或之后进展的复发性或转移性宫颈癌患者。临床治疗的重要终点为客观有效率和缓解持续时间。客观缓解率为24%,中位缓解持续时间为8.3个月。主要副作用为疲劳,恶心,外周神经病变,干眼等。
 恩美曲妥珠单抗
恩美曲妥珠单抗 注射剂
160mg/瓶| 100mg/瓶
 瑞士罗氏
瑞士罗氏
抗体-药物偶联物,用于HER2阳性乳腺癌或肺癌,减少复发
2023-05-19 15:25:23
2026-01-15 13:55:13
2026-01-15 13:47:42
2026-01-15 11:56:27
2026-01-15 11:40:40
2026-01-15 11:36:02
2026-01-14 20:52:28
2026-01-14 20:46:25
2026-01-14 20:33:22
2026-01-14 20:18:56