

抗体-药物偶联物,用于HER2阳性乳腺癌或肺癌,减少复发
 瑞士罗氏
瑞士罗氏  用法用量
用法用量 副作用
副作用  注意事项
注意事项  适应症
适应症  药物相互作用
药物相互作用 1.转移性乳腺癌:
作为单一药物,适用于治疗HER2阳性转移性乳腺癌患者,之前曾单独或联合使用过曲妥珠单抗和紫杉烷,患者应具备以下条件之一:
①之前接受过转移性疾病的治疗
②在完成辅助治疗期间或6个月内发生疾病复发
2.早期乳腺癌:
作为单一药物,用于HER2阳性早期乳腺癌患者在新辅助治疗和曲妥珠单抗治疗后有残留侵袭性疾病的辅助治疗
推荐剂量是3.6mg/kg,静脉输注,每3周1次,直至疾病进展或出现不能耐受的毒性,禁止用量超过3.6mg/kg,禁止恩美曲妥单抗珠与曲妥珠单抗相互代替使用
如出现不耐受反应,应减量使用,推荐剂量递减表如下:
| 剂量减少次数 | 剂量调整 |
| 原始剂量 | 3.6mg/kg |
| 第一次 | 3.0mg/kg |
| 第二次 | 2.4mg/kg |
| 仍不耐受 | 永久停药 |
第一次输注:90分钟以上,在输注期间和初始剂量后至少应观察患者是否有发热、发冷或其他输注相关反应90分
钟
后续输注:如果之前的输注耐受良好,则给药超过30分钟,输注期间和输注后至少应观察患者30分钟
如果患者出现输注相关症状,应减慢本品的输注速率或中断给药, 出现危及生命的输液反应时,应终止治疗
本品须由专业医疗人员复溶和稀释,并采用静脉输注给药,不得静脉推注或快速静脉注射
早期乳腺癌患者应接受共 14 个周期的治疗,除非疾病复发或出现无法控制的毒性
当遗漏一次计划给药时,应尽快给药,切勿等到下次计划周期时给药,同时应调整给药时间表,确保后续给药间隔为 3 周。可按照患者最近一次输注时可耐受的速率进行给药
表1 不良反应推荐剂量减少表
剂量调整 | 推荐剂量 |
起始剂量 | 3.6 mg/kg |
第一次减量 | 3 mg/kg |
第二次减量 | 2.4 mg/kg |
需要进一步减量 | 停止用药 |
表2 不同不良反应推荐剂量减少表
转移性乳腺癌患者剂量调整 | ||
不良反应 | 严重程度 | 剂量修改 |
转氨酶增加(AST/ALT) | 2级(谷草转氨酶或谷丙转氨酶增加到正常上限的2.5倍以上,5倍以下) | 以相同的剂量水平进行治疗 |
3级(谷草转氨酶或谷丙转氨酶增加到正常上限的5倍以上,20倍以下) | 在该不良反应恢复到≤2级之前,暂停给药,然后降低一个剂量水平恢复给药(参考表1) | |
4级(谷草转氨酶或谷丙转氨酶增加到正常上限的20倍及以上) | 停药 | |
高血胆红素症 | 2级(胆红素增加到正常上限的1.5倍以上,3倍以下) | 在总胆红素恢复到≤1级之前,暂停给药,然后以此前相同剂量水平治疗 |
3级(胆红素增加到正常上限的3倍以上,10倍以下) | 在总胆红素恢复到≤1级之前,暂停给药,然后降低一个剂量水平恢复给药(参考表1) | |
4级(胆红素增加到正常上限的10倍及以上) | 停药 | |
药物性肝损伤 (DILI) | 血清转氨酶增加到正常上限的3倍 且 伴随的总胆红素增加到正常上限的2倍以上 | 在没有其他可能导致肝酶和胆红素升高的原因时(比如肝转移或伴随药物治疗),永久停药 |
结节性再生性增生 (NRH) | 所有等级 | 永久停药 |
血小板减少(症) | 3级(血小板计数范围在25,000 -50,000/mm3) | 在血小板计数恢复到1级(≥75000/mm3)之前,暂停给药,然后以和此前相同的剂量水平治疗 |
4级(血小板计数≤25,000/mm3) | 在血小板计数恢复到1级(≥75000/mm3)之前,暂停给药,然后降低一个剂量水平(参考表1) | |
左心室功能紊乱 | 有症状的充血性心衰 | 停药 |
左心射血分数 < 40% | 暂停用药,在3周内重复左心射血分数评估。如果确认左心射血分数 < 40%,停药 | |
左心射血分数为40%至≤45%,且较基线下降≥10% | 暂停用药,在3周内重复左心射血分数检测。如果左心射血分数的下降幅度没有恢复到基线的10%以内,停药 | |
左心射血分数 40% 至 ≤ 45% 且较基线下降<10% | 继续治疗,在3周内重复左心射血分数评估 | |
左心射血分数 > 45% | 继续用药 | |
肺毒性 | 间质性肺病(ILD)或肺炎 | 永久停药 |
周围神经病变 | 3级-4级 | 暂停用药,直到该不良反应恢复到≤2级 |
早期乳腺癌患者剂量调整 | ||
不良反应 | 严重程度 | 剂量修改 |
谷丙转氨酶(ALT)增加 | 2级-3级(在计划用药的当天谷丙转氨酶增加到正常上限的3倍以上,20倍以下包括20倍 ) | 在谷丙转氨酶恢复到≤1级前暂停用药, 然后减少一个剂量水平(参考表1) |
4级(谷丙转氨酶增加到正常上限的20倍以上) | 停药 | |
谷草转氨酶(AST)增加 | 2级(在计划用药的当天谷草转氨酶增加到正常上限的3倍以上,5倍以下包括5倍) | 在谷草转氨酶恢复到≤1级前暂停用药,然后以和此前相同的剂量水平治疗 |
3级(在计划用药的当天谷草转氨酶增加到正常上限的5倍以上,20倍以下包括20倍) | 在谷草转氨酶恢复到≤1级前暂停用药, 然后减少一个剂量水平(参考表1) | |
4级(谷草转氨酶增加到正常上限的20倍以上) | 停药 | |
高血胆红素症 | 在计划用药的当天胆红素增加到正常上限的1倍以上,2倍以下包括2倍 | 暂停用药,在总胆红素恢复到1倍正常上限及以下后,降低一个剂量水平给药(参考表1) |
胆红素增加到正常上限的2倍以上 | 停药 | |
结节性再生性增生(NRH) | 所有等级 | 永久停药 |
血小板减少(症) | 计划治疗的当天达到2级-3级 (血小板计数范围在25,000 -75,000/mm3) | 在血小板计数恢复到1级(血小板计数≥75000/mm3)之前,暂停给药,然后以和此前相同的剂量水平治疗 如果患者因血小板减少需要2次延迟给药,则考虑将剂量降低一个水平(参考表1) |
4级(血小板计数< 25,000/mm3) | 在血小板计数恢复到1级(血小板计数≥75000/mm3)之前,暂停给药,然后降低一个剂量水平(参考表1)
| |
左心室功能紊乱 | 左心射血分数 < 45% | 暂停用药,在3周内重复左心射血分数评估。如果确认左心射血分数 < 45%,停药 |
左心射血分数 45% 至 ≤ 50% 且较基线下降≥10%* | 暂停用药,在3周内重复左心射血分数检测。如果左心射血分数保持在<50%且下降幅度没有恢复到基线的10%以内,停药 | |
左心射血分数 45% 至 < 50% 且较基线下降<10%* | 继续治疗,在3周内重复左心射血分数评估 | |
LVEF ≥ 50% | 继续治疗 | |
心力衰竭 | 有症状的充血性心衰3级-4级的左心室收缩功能障碍 或 3级-4级的心力衰竭 或 2级心力衰竭伴随左心射血分数 < 45% | 停药 |
周围神经病变 | 3级-4级 | 暂停用药,直至该不良反应恢复至≤2级 |
肺毒性 | 间质性肺病(ILD)或肺炎 | 永久停药 |
放射治疗相关性肺炎 | 2级 | 如果标准治疗后没有恢复,则停药 |
3级-4级 | 停药 | |
*:开始使用本药之前
1.不良反应转移性乳腺癌
最常见的不良反应(≥25%)为疲劳、恶心、肌肉骨骼疼痛、出血、血小板减少、头痛、转氨酶升高、便秘和鼻出血
2.早期乳腺癌
最常见的不良反应(≥25%)是疲劳、恶心、转氨酶升高、肌肉骨骼疼痛、出血、血小板减少、头痛、周围神经病变和关节痛
尚未明确
未使用的样品瓶:在2-8ºC冷藏; 重组的小瓶或稀释的溶液,冷藏温度为2-8ºC,4小时后丢弃,不要冻结
成人
同时使用强CYP3A4抑制剂,可能会造成不良反应严重程度增加,因此应避免与其共用(如酮康唑、伊曲康唑、克拉霉素、阿他那韦、奈法唑酮、奈非那韦、利托那韦、沙奎那韦、特利霉素和伏立康唑)
目前还没有对恩美曲妥珠单抗进行正式的药物相互作用研究
36个月
注射剂
瑞士罗氏
本品活性成份:恩美曲妥珠单抗
化学结构如下:
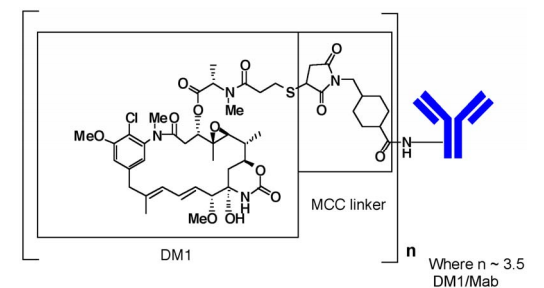
白色至类白色无菌冻干粉:每瓶100mg/160 mg
诊断有间质性肺病或肺炎患者中永久停药
输注期间和输注后监视体征和症状,如发生严重输液相关反应或超敏性反应,减慢或中断输液并给予适当医学治疗,对危及生命输液相关反应永久停药
在临床试验中发生过致命的出血病例,这些病例并没有已知的确定危险因素、血小板减少症的患者以及正在使用抗凝血和抗血小板治疗的患者,使用本品时应注意这些情况,如果必须联合这类药物使用,应提高监测频率
每次给药前应监测血小板计数,适当时调整剂量
监视体征和症状,对3-4级周围神经病变患者应暂停给药
使用FDA批准的检验进行检测,确定HER2阳性转移性乳腺癌患者可给予用药
(以上参考自FDA美国药监局英文说明书2022.02版)
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参