摘要:替西帕肽最新数据亮相,中国糖尿病患者有望实现高效控糖
糖尿病人数近年来剧增,世界卫生组织(WHO)预计17年后,患者人数可高达6.42亿,其中2型糖尿病(T2DM)是最常见的糖尿病类型。我国2015年-2017年调查显示,2型糖尿病男性患病率为12.1%,女性患病率为10.3%,男性高于女性。有一半以上患者在早期无明显症状,随后可出现“三多一少”—多尿、多饮、多食,体重减轻,以及视力下降和皮肤瘙痒等表现。最令人担忧的是,我国2型糖尿病的流行逐渐呈现年轻化趋势。

2型糖尿病治疗以控制血糖为主,尽管市面上已有许多药物用于治疗该疾病,但大多数患者并未达到目标血糖值,而研究人员发现,替西帕肽可有效改善血糖,并且亚太地区患者获益更加显著,这为中国2型糖尿病患者带来了福音。
2022年5月13日,美国药监局(FDA)批准美国礼来公司研发的替西帕肽(Mounjaro、Tirzepatide)在美国上市,批准其用于配合饮食和运动,以改善2型糖尿病患者对血糖的控制。
2型糖尿病多因身体无法正常产生或使用胰岛素,导致血液中葡萄糖(糖)水平升高引起,而胰高血糖素样肽-1 (GLP-1) 和葡萄糖依赖性促胰岛素多肽 (GIP) 是参与血糖控制的激素。替西帕肽作为双靶点高效控糖药物,可激活GLP-1和GIP受体,从而改善激素对血糖的控制。
替西帕肽通过皮下注射给药,剂量可根据患者耐受程度进行调整,以达到目标血糖值,其推荐剂量如下:
(1)推荐起始剂量为2.5mg,皮下注射每周一次,该剂量用于开始治疗,不可用于血糖控制。
(2)4周后,将剂量增加至5mg,皮下注射每周一次,若需要额外加强对患者血糖的控制,则应剂量不变持续用药至少4 周,在当前剂量的基础上以2.5mg为增量增加用量。
(3)替西帕肽最大用药剂量为15mg,皮下注射每周一次。
(4)如果漏用了一剂,则应在漏用后4天内尽快补用,需与下一剂用药至少间隔3天。若患者漏用替西帕肽超过4天以上,无需补用,按照正常用药计划注射下一剂,随后恢复为每周用药一次。
FDA药物评价和研究中心的糖尿病、脂质紊乱和糖尿病科副主任—医学博士Patrick Archdeacon表示,“达到目标血糖值仍是许多患者面临的挑战,而替西帕肽的获批将是2型糖尿病治疗史上的重大进步。”

这一结论基于FDA对多项替西帕肽相关临床试验进行的汇总分析,研究人员发现随机接受该药最大推荐剂量单药治疗的患者,其糖化血红蛋白(HbA1c)水平比安慰剂多降低1.6%,并且与长效胰岛素联合使用时,比安慰剂多降低1.5%。在比较替西帕肽与其他糖尿病药物的临床试验中,接受该药最大推荐剂量治疗的患者,其糖化血红蛋白水平比德谷胰岛素多降低0.9%,比索马鲁肽多降低0.5%,比甘精胰岛素多降低1.0%。
随着替西帕肽的上市,北京大学人民医院内分泌科纪立农教授进一步探索了该药在以中国2型糖尿病患者为主的人群中的疗效和安全性,并于2023年5月25日将SURPASS-AP-Combo试验结果发表在《自然医学杂志》上。
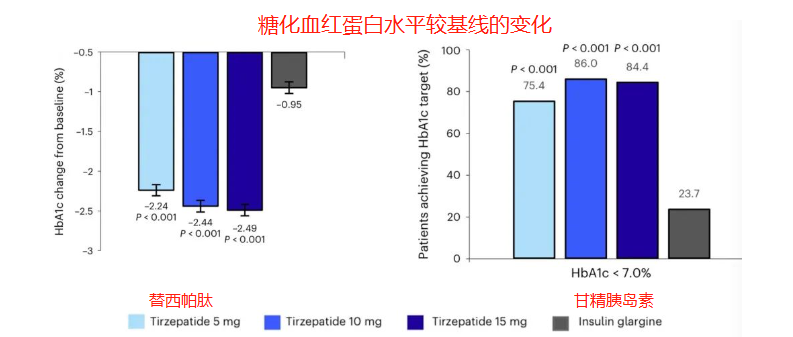
结果显示,治疗40周后,替西帕肽5mg治疗组患者的糖化血红蛋白水平较基线降低2.24%,10mg治疗组患者降低2.44%,15mg治疗组患者降低2.49%,三组均显著优于甘精胰岛素治疗组,甘精胰岛素治疗组糖化血红蛋白水平较基线仅降低0.95%。治疗第40周时,替西帕肽治疗组达到糖化血红蛋白<7.0%的患者比例最高可达86.0%,甘精胰岛素治疗组为23.7%,替西帕肽治疗组是甘精胰岛素治疗组的3.6倍以上。
此外,治疗期间两组均未报告发生严重低血糖,最常见的不良反应包括食欲减退和轻、中度胃肠道不良反应(如恶心、腹泻、呕吐)。
以上结果与之前SURPASS系列试验中报告的基本一致,这表明替西帕肽在以中国患者为主的亚太地区2型糖尿病患者中也具有良好的疗效和安全性。2022年9月,该药上市申请获中国药监局(NMPA)受理,替西帕肽在中国上市指日可待!
 替西帕肽
替西帕肽 注射剂
2.5mg/0.5 mL|5mg/0.5mL等
 美国礼来Lilly
美国礼来Lilly
存在二型糖尿病的成人糖尿病患者。
2025-12-12 22:03:14
2025-12-12 21:55:45
2025-12-12 21:52:18
2025-12-12 21:48:48
2025-12-12 21:44:01
2025-04-22 13:50:21
2025-04-22 13:33:06
2025-04-22 13:18:30
2025-04-22 13:09:35
2025-04-22 13:04:33