摘要:埃万妥单抗在国内已处于申请上市阶段,多项临床试验正在紧锣密鼓地开展中,相信在不久的将来,该药就能在国内上市,造福更多患者。
全球肺癌发病率和死亡率高居全球所有恶性肿瘤的首位,其中非小细胞肺癌(NSCLC)占85%,而表皮生长因子受体(EGFR)突变随着研究的深入逐渐被重视。其中外显子20插入(exon20ins)突变约占EGFR突变非小细胞肺癌的12%,是EGFR第三大突变,异质性和恶性程度高,其亚型多达百种,并且不同的插入位点亚型临床获益不同,患者普遍预后不佳,临床上EGFR exon20ins突变的非小细胞肺癌亟需新的治疗药物。
EGFR
exon20ins突变的非小细胞肺癌对已获批的酪氨酸激酶抑制剂均表现出固有的耐药性,而埃万妥单抗(Rybrevant)是一种具有免疫细胞导向活性的表皮生长因子受体-间充质上皮转化因子(EGFR-MET)双特异性抗体,可与每个受体的胞外结构域结合,避开酪氨酸激酶抑制剂结合位点的耐药性。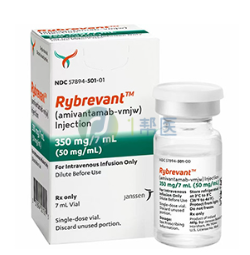
2021年5月21日,埃万妥单抗首次在美国获批,适用于治疗在铂类化疗期间或治疗后出现进展的EGFR exon20ins突变的局晚期或转移性非小细胞肺癌成人患者,这是肺癌治疗史上的又一里程碑事件。
CHRYSALIS研究旨在评估埃万妥单抗用于既往接受过铂类治疗的EGFR exon20ins突变非小细胞肺癌的疗效和安全性,主要终点是剂量限制性毒性(DLT)和客观缓解率(ORR)。
研究结果显示,在有效人群中客观缓解率为 40%,其中3例达到完全缓解,中位无进展生存期(PFS)为8.3个月。中位缓解持续时间(DOR)为 11.1 个月,63%的患者缓解持续时间≧6个月。
在安全人群中,最常见的不良反应为皮疹(86%)、输液相关反应(66%)和甲沟炎(45%)。最常见的 3-4 级不良反应是低钾血症、皮疹、肺栓塞、腹泻和中性粒细胞减少症。
CHRYSALIS研究证实埃万妥单抗通过独特的作用机制,在经铂类化疗期间或之后进展的EGFR exon20ins突变非小细胞肺癌患者中产生了强劲而持久的反应,且安全性较好。基于以上研究结果,FDA加速批准了埃万妥单抗上市。
截止到2023年8月,美国杨森制药研发的埃万妥单抗尚未在中国上市,除直接去国外上市地区购买外,患者也可以通过以药队长为代表的海外医疗机构,选择海外药房直邮购药,目前规格为350mg/7ml的埃万妥单抗,售价约为11500元一盒。

埃万妥单抗在国内已处于申请上市阶段,多项临床试验正在紧锣密鼓地开展中,相信在不久的将来,该药就能在国内上市,造福更多患者。

 埃万妥单抗(Rybrevant)
埃万妥单抗(Rybrevant) 注射剂
350mg/7ml
 美国杨森
美国杨森
新型EGFR/c-Met双抗药,改善非小细胞肺癌疾病进展
2025-04-28 13:32:54
2025-04-14 19:53:36
2022-05-17 17:40:34
2022-05-17 17:46:55
2022-06-21 13:59:46
2022-06-21 14:05:42
2022-08-03 16:38:46
2022-11-30 14:36:08
2023-08-04 16:16:40
2023-08-07 17:07:20