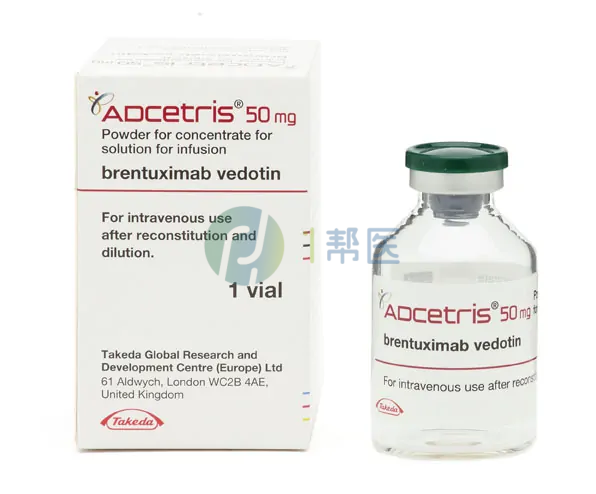
维布妥昔单抗由靶向CD30的单克隆抗体和微管破坏剂MMAE通过一种蛋白酶敏感的交联剂偶联而成。一旦进入表达CD30的细胞内,它会被内吞并释放MMAE。MMAE随后与微管蛋白结合,破坏细胞内的微管网络,导致细胞周期停滞和细胞凋亡死亡。
药品称呼
通用名:注射用维布妥昔单抗
商品名:安适利
全部名称:维布妥昔单抗,注射用维布妥昔单抗,安适利,ADCETRIS,Brentuximab Vedotin ,BV
禁忌
对本品活性成分维布妥昔单抗或其他任何辅料过敏者禁用。由于肺毒性,维布妥昔单抗不可与博来霉素合并使用。
贮藏
2 ~ 8˚C 避光保存,不可冷冻。并将药瓶保存于原包装盒中,避光。
在复溶/稀释后,应立即使用本品。若不能及时使用,应将复溶/稀释后的溶液保存于2°C ~ 8°C,最长可保存24个小时。
作用机制
安适利®(注射用维布妥昔单抗)是由靶向CD30的单克隆抗体连接一种抑制微管的细胞毒药物(单甲基澳瑞他汀E,MMAE)组成,可在血液中稳定存在,精准杀灭表达CD30的肿瘤细胞。
安全与疗效
最初两项Ⅱ期研究SG035-0003和SG035-0004证实了BV在经典霍奇金淋巴瘤(CHL)和系统性间变性大细胞淋巴瘤(sALCL)中的有效性。BV治疗复发或难治性CHL患者(102例)的ORR高达75%,而5年生存率达41%;治疗复发或难治性sALCL患者(58例)的ORR和5年生存率分别高达86%和60%。
后续在复发或难治性霍奇金淋巴瘤患者中进行的Ⅲ期研究AETHERA(329例)进一步证实,患者自体造血干细胞移植(ASCT)后,给予BV 16疗程巩固治疗,与安慰剂相比,显著改善患者的中位PFS(42.9 vs. 24.1个月,P=0.0013)。在其他CD30阳性淋巴瘤中,BV同样显示有效。
ALCANZA Ⅲ期研究(131例)结果显示,与经医师选择的治疗方案甲氨蝶呤或贝沙罗汀相比,BV治疗CD30阳性的皮肤T细胞淋巴瘤(CTCL)可显著提高患者持续≥4个月的ORR(13% vs. 56%,P<0.000 1),并延长患者的中位PFS(3.5 vs. 16.7个月,P<0.0001)。
完整说明书详见:
生产厂家
日本武田
成分
CD30导向的抗体-药物缀合物,由三种成分组成,1)嵌合IgG1抗体cAC10,对人体CD30特异 2)微管破坏剂MMAE 3)将MMAE共价连接到cAC10的蛋白酶可裂解接头
性状
无菌、白色至灰白色、不含防腐剂的块状物或粉末
适应症
1、霍奇金淋巴瘤
维布妥昔单抗适用于自体干细胞移植(ASCT)失败后的霍奇金淋巴瘤(HL)患者,或在非ASCT候选人患者中至少两次先前多药化疗方案失败后的患者。
总体缓解率73%,完全缓解率32%——FDA维布妥昔单抗药品实验说明书临床试验章节
2、系统性间变性大细胞淋巴瘤
维布妥昔单抗适用于在至少一种多药化疗方案失败后的系统性间变性大细胞淋巴瘤(sALCL)患者的治疗。
总体缓解率86%,完全缓解率57%——FDA维布妥昔单抗药品实验说明书临床试验章节
用法用量
1、维布妥昔单抗应在具有抗癌药使用经验的医师监督下使用。
2、维布妥昔单抗不能静脉推注或快速滴注给药。
只能通过专门的静脉通路给药,不可与其他药物混合。
3、本品推荐剂量为1.8mg/kg,30分钟以上静脉输注给药,每3周1次,直至疾病进展或出现不可接受的毒性。
最多治疗16周期。
4、周围神经性病变:周围神经病变应采用延迟给药和减少至1.2mg/kg相结合的方法进行治疗。
对于新的或恶化的2级或3级病变,应停止给药,直到神经病变改善至1级或基线,然后再1.2mg/kg。
对于4级神经病变,应停止给药。
5、中性粒细胞减少症:中性粒细胞减少应采用延迟给药和减少剂量来控制。
对于3级或4级中性粒细胞减少症,应保持维布妥昔单抗的剂量,直至缓解至基线或2级或更低。
对于经历3级或4级的中性粒细胞减少症的患者,应考虑在随后的周期中给予生长因子的支持。
尽管使用了生长因子,但对于复发性4级中性粒细胞减少症,应考虑停药或将计量较少至1.2mg/kg。
6、如果患者体重大于100kg,使用100kg计算剂量。
每次给药前,应监测全血细胞计数。
在输注期间及输注后,应监测患者情况。
治疗应持续至疾病进展或出现不可耐受的毒性。
患有复发或难治性cHL或sALCL且疾病稳定或改善的患者应至少接受8个周期和至多16个周期(约1年)的治疗。
不良反应
最常见的不良反应(≥20%)
中性粒细胞减少症、外周感觉神经病变、疲劳、恶心、上呼吸道感染、发热、皮疹、血小板减少症、咳嗽和呕吐
霍奇金淋巴瘤患者最常见的严重不良反应
外周感觉神经病变(4%)、腹痛(3%)、肺栓塞(2%)、肺炎(2%)、气胸(2%)、肾盂肾炎(2%)、
发热(2%)
系统性间变性淋巴瘤患者最大的严重不良反应
感染性休克(3%)、室上性心律失常(3%)、四肢疼痛(3%)和尿路感染(3%)
禁忌
对本品活性成分维布妥昔单抗或其他任何辅料过敏者禁用。
由于肺毒性,维布妥昔单抗不可与博来霉素合并使用。
贮存方法
2 ~ 8˚C 避光保存,不可冷冻。并将药瓶保存于原包装盒中,避光。 在复溶/稀释后,应立即使用本品。若不能及时使用,应将复溶/稀释后的溶液保存于2°C ~ 8°C,最长可保存24个小时。
适用人群
本品为靶向CD30 的抗体偶联药物(ADC),适用于系统性间变性大细胞淋巴瘤(sALCL); 复发或难治性经典型霍奇金淋巴瘤(cHL)。
药物相互作用
其他药物对维布妥昔单抗的影响
CYP2A4抑制剂/诱导剂:抗微管药物MMAE主要通过CYP3A代谢,维布妥昔单抗与酮康唑(一种强效CYP3A4抑制剂)合用可增加约34%MMAE暴露。
应密切监测正在接受强效CYP3A4抑制剂并合用维布妥昔单抗患者的不良反应。
维布妥昔单抗与利福平(一种强效CYP3A4诱导剂)合用,可减少MMAE约46%的暴露。
维布妥昔单抗对其他药物的影响
合用维布妥昔单抗不会增加CYP3A4底物咪达唑仑的暴露,在临床相关浓度下,MMAE不影响其他CYP酶。
有效期
48个月
剂型
注射剂
注意事项
周围神经病变
维布妥昔单抗治疗引起的周围神经病变主要为感觉性周围神经病变。
还报告过周围运动神经病变病例。
维布妥昔单抗诱导的周围神经病变具有累积效应。
对患者进行神经病变症状的监测,如感觉减退、感觉过敏、感觉异常、不适、烧灼感、神经性疼痛或虚弱。
新发周围神经病变或周围神经病变恶化的患者可能需要推迟给药,改变剂量或终止维布妥昔单抗治疗。
嗜中性白细胞减少症
在维布妥昔单抗每次给药前,应监测全血细胞计数。
对于3级或4级中性粒细胞减少症患者,应考虑进行更频繁的检测,维布妥昔单抗可出现长期的(≥1周)严重的中性粒细胞减少症,如果出现3级或4级中性粒细胞减少症,则通过延迟给药、减少给药或停药进行管理。
速发过敏反应和输液相关反应
维布妥昔单抗治疗时发生的输液相关反应包括速发过敏反应
输液期间应监测患者。
如果发生速发过敏反应,则应立即并永久性终止使用维布妥昔单抗,并进行适当的治疗。
如果发生输液相关反应,应立即中断输液,并采取适当的治疗。
对于既往发生过输液相关反应的患者,应在后续输液前采取预防用药。
预防用药包括对乙酰氨基酚、抗组胺药物和糖皮质激素。
血液毒性
维布妥昔单抗治疗后有致死性和严重的发热性中性粒细胞减少症病例的报告。
可引起持续的(≥1周)重度中性粒细胞减少症,3级或4级血小板减少症或贫血。
在维布妥昔单抗每次给药前,应监测全血细胞计数。
对3级或4级中性粒细胞减少症患者应更频繁地监测。
应监测患者的发热情况。
如果发生3级或4级中性粒细胞减少症,考虑推迟给药、降低剂量、终止治疗或在后续维布妥昔单抗剂量治疗时进行G-CSF预防。
严重感染和机会性感染
在接受维布妥昔单抗治疗的患者中有报告严重感染和机会性感染,如肺炎、菌血症和败血症,或感染性休克(包括致死性结局)。
治疗期间,应密切监测患者可能出现的细菌、真菌或病毒感染。
肿瘤溶解综合征
肿瘤增殖迅速和肿瘤负荷高的患者发生肿瘤溶解综合征的风险较高。
应密切监测并采取适当的措施。
重度肾损害患者的毒性增加
重度肾损害患者发生≥3级不良反应和死亡的频率高于肾功能正常的患者。
由于MMAE暴露量较高,重度肾损害患者发生≥3级不良反应的频率可能高于肾功能正常的患者。
重度肾损害[肌酐清除率(CrCL)<30ml/min]患者避免使用维布妥昔单抗。
中度或重度肝损害患者的毒性增加:中度和重度肝损害患者发生≥3级不良反应和死亡的频率高于肝功能正常的患者。
中度(ChildPughB级)或重度(ChildPughC级)肝损害患者避免使用维布妥昔单抗治疗。
肝毒性
接受维布妥昔单抗治疗的患者曾报告严重的肝毒性病例,包括致死性结局。
此类病例与肝细胞损伤一致,包括转氨酶和/或胆红素升高。
在维布妥昔单抗首次给药后或维布妥昔单抗再治疗后发生此类事件。
既存肝病、基线肝酶升高和合并用药也可能增高肝毒性风险。
应监测肝酶和胆红素。
出现新发肝毒性、肝毒性恶化或复发性肝毒性的患者可能需要延迟给药、调整剂量或终止维布妥昔单抗给药。
进行性多灶性白质脑病
在使用维布妥昔单抗治疗的患者中,JohnCunningham病毒(JCV)感染可导致进行性多灶性白质脑病(PML),并可诱发死亡。
维布妥昔单抗治疗开始后,首次症状发作时间不同,部分病例发生于初始暴露后3个月内。
除维布妥昔单抗治疗外,其它可能的诱发因素包括既往治疗和可能导致免疫抑制的基础疾病。
在出现新发中枢神经系统异常体征和症状的患者中,考虑诊断PML。
任何疑似PML病例暂停维布妥昔单抗给药,如果可疑PML,暂停给药。
如果确诊为PML,终止维布妥昔单抗给药。
肺毒性
已经报告了非感染性肺毒性事件,包括肺炎、间质性肺病和急性呼吸窘迫综合征(ARDS),部分病例具有致死性结局。
应监测患者是否出现肺毒性的体征和症状,包括咳嗽和呼吸困难。
如果出现新发肺部症状或肺部症状恶化,在评价期间暂停维布妥昔单抗单抗给药,直至症状改善。
严重皮肤反应
在维布妥昔治疗时报告过Stevens-Johnson综合征(SJS)和中毒性表皮坏死松解症(TEN),包括致死性结局。
若发生SJS或TEN,终止维布妥昔单抗给药,并应提供适当医学治疗。
胃肠道并发症
接受维布妥昔单抗治疗的患者曾报告急性胰腺炎,包括致死性结局。
其他致死性和严重胃肠道(GI)并发症包括穿孔、出血、糜烂、溃疡、肠梗阻、小肠结肠炎、中性粒细胞减少性结肠炎。
既存GI受累的淋巴瘤可能增加穿孔风险。
如果新发GI症状或GI症状恶化,包括重度腹痛,立即进行诊断评估,并对患者进行适当治疗。
高血糖
已在维布妥昔单抗治疗患者中报告严重的高血糖事件,如新发的高血糖症,原有症状恶化的糖尿病和酮症酸中毒(包括致命结局)。
在维布妥昔单抗单药疗法的研究中,8%的患者出现任何级别的高血糖,6%的患者出现3级或4级高血糖。
任何级别、3级或4级发病时间中位数为1个月(范围0-10)。
高血糖多发出现在高体重指数或糖尿病患者身上。
监测血糖,如出现高血糖进展,按临床所示服用抗高血糖药物。
胚胎-胎儿毒性
根据作用机制和在动物中的结果,若对妊娠女性给药,维布妥昔单抗会对胎儿造成伤害。
尚没有在妊娠女性中开展充分的、对照良好的维布妥昔单抗研究。
维布妥昔单抗在母体暴露的动物造成胚胎-胎儿毒性,包括显著降低胚胎活力和胎儿畸形,其与1.8mg/kg,每3周1次的临床剂量相似。
告知有生育能力的女性,在维布妥昔单抗治疗期间及维布妥昔末次给药后至少6个月内,应避免妊娠。
如在妊娠期间使用了维布妥昔单抗或是患者在维布妥昔单抗治疗期间妊娠,应告知患者对胎儿的潜在风险。
史蒂文-约翰逊综合征
曾有使用维布妥昔单抗出现史蒂文-约翰逊综合征的报道,如果用药过程中出现史蒂文-约翰逊综合征,应立即停药并进行治疗。
辅料中的钠盐
该药物中每剂最多含2.1mmol(或47mg)钠盐。
患者应当考虑控制钠饮食。



 日本武田
日本武田  在线咨询
在线咨询 
 中国恒瑞
中国恒瑞
 德国拜耳
德国拜耳
 用法用量
用法用量