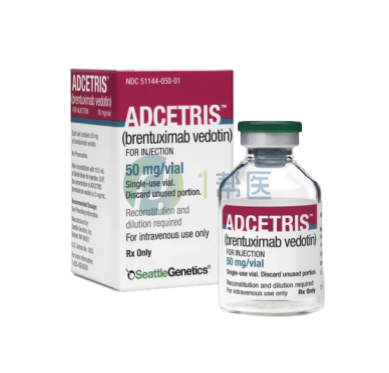
Adcetris是一种抗体偶联药物(ADC),由靶向CD30蛋白的单克隆抗体和微管破坏剂通过一种蛋白酶敏感的交联剂偶联而成。在被CD30阳性肿瘤细胞内化后,可释放出MMAE,抑制微管蛋白的聚合作用,阻碍细胞分裂,达到杀灭肿瘤细胞的效果。
药品称呼
通用名:brentuximab vedotin
商品名称:Adcetris
全部名称:本妥昔单抗,CD30单抗,Adcetris,brentuximab vedotin
禁忌
因肺毒性同时使用brentuximab和bleomycin
贮藏
1、未打开的小瓶:在2-8°C(36-46°F)的原始纸箱中冷藏以防光照
2、稀释的溶液或复原的小瓶:在2-8°C(36-46°F)下冷藏最多24小时
3、不要冻结
作用机制
CD30定向抗体-药物偶联物(ADC),由对人CD30特异的嵌合IgG1抗体cAC10和微管破坏剂,单甲基澳瑞他汀E(MMAE或vedotin)组成。
缀合物与表达CD30抗原的细胞结合并形成复合物,该复合物在细胞内被内化并释放MMAE。MMAE通过与小管结合并破坏细胞微管网络来诱导细胞周期(G2 / M期)停滞。
疗效和安全
获批是基于III期临床研究ECHELON-2的数据。该研究是迄今为止在PTCL患者中开展的最大规模的随机、双盲III期研究,入组的是先前未接受治疗的CD30阳性PTCL患者,评估了Adcetris联合化疗方案CHP(环磷酰胺+阿霉素+强的松)用于一线治疗时相对于目前公认的治疗PTCL的一线标准护理方案CHOP(环磷酰胺+阿霉素+长春新碱+强的松)的疗效和安全性。研究的主要终点是双盲独立中央审查机构(BICR)评估的无进展生存期(PFS)。
结果显示,与CHOP方案相比,Adcetris+CHP方案使PFS实现了统计学意义的显著改善,相当于将疾病进展、死亡、接受后续抗癌化疗以治疗残留或进展性疾病的风险降低了29%(BICR:HR=0.71,95%CI:0.54-0.93,p=0.011),达到了研究的主要终点。
此外,与CHOP方案相比,Adcetris+CHP方案在关键次要终点总生存期(OS)方面也表现出优越性(HR=0.66,95%CI:0.46-0.95,p=0.0244)。
其他关键次要终点方面,Adcetris+CHP方案也表现出统计学意义的显著优势,包括:sALCL患者中的PFS(HR=0.59;95%CI:0.42-0.84,p=0.003),完全缓解率(CRR:68% vs 56%,p=0.007),客观缓解率(ORR:83% vs 72%,p=0.003)。
该研究中,Adcetris+CHP方案与CHOP方案具有可比的安全性,并与Adcetris和化疗组合方案已确立的安全性一致。
完整说明书详见:



 日本武田
日本武田  在线咨询
在线咨询 
 中国艾力斯
中国艾力斯
 瑞士罗氏
瑞士罗氏
 孟加拉珠峰
孟加拉珠峰
 用法用量
用法用量