


微管抑制剂,用于前列腺癌乳腺癌卵巢癌,耐受性好
 法国赛诺菲
法国赛诺菲  用法用量
用法用量 副作用
副作用  注意事项
注意事项  适应症
适应症  药物相互作用
药物相互作用 本品适用于与强的松联合用药的先前接受了含多西他赛的治疗方案的现转移性去势抵抗性前列腺癌患者。
(1)本品的推荐剂量是基于体表面积(BSA)的计算,每三周静脉输注1小时20mg/m2,联合口服强的松10mg,在本品治疗期间每天给药。
(2)对于具有高危临床特征的患者,推荐使用粒细胞集落刺激因子进行初级预防,在所有接受25mg/m2剂量的患者中考虑粒细胞集落刺激因子的初级预防。
(3)在每次给药前至少30分钟使用以下静脉药物,以降低过敏的风险和/或严重程度:
①抗组胺药(右氯苯那敏5mg,苯海拉明25mg或同等剂量的抗组胺药)。
②皮质类固醇(地塞米松8mg或等效类固醇)。
③H2拮抗剂。
(4)建议预防止吐,并可根据需要口服或静脉注射。
(5)本品注射单剂量瓶在给药前需要两次稀释。
(1)减少或停止本品的剂量见表1。
表1:本品治疗患者不良反应的推荐剂量调整
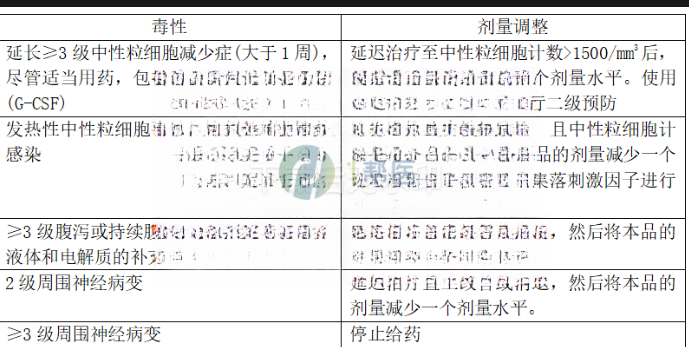
20mg/m2剂量需要减量的患者应将本品的剂量减少至15mg/m2,25mg/m2剂量的患者应将本品的剂量减少至20mg/m2,可以考虑再减少一次剂量至15mg/m2。
(1)轻度肝功能损害(总胆红素>1~≤1.5×正常值上限(ULN)或AST>1.5×ULN):给药20mg/m2。
(2)中度肝功能损害(总胆红素>1.5~≤3×ULN, AST=任何):根据这些患者的耐受性数据,给予本品15mg/m2的剂量,然而,这一剂量的疗效尚不清楚。
(3)严重肝功能损害(总胆红素>3×ULN): 禁忌用于严重肝功能损害患者。
同时使用强CYP3A抑制剂的药物(如酮康唑、伊曲康唑、克拉霉素、阿他那韦、因地那韦、奈法唑酮、奈非那韦、利托那韦、沙奎那韦、泰利霉素、伏立康唑)可增加卡巴他赛的血浆浓度,避免与这些药物同时使用本品,如果患者需要联合使用强CYP3A抑制剂,可以考虑减少25%的本品剂量。
(1)本品是一种细胞毒性抗癌药物,需遵循适用的特殊处理和处置程序,如果本品第一次稀释溶液或第二次(最终)稀释静脉输注接触到皮肤或粘膜,立即用肥皂和水彻底清洗。
(2)不要使用PVC输液容器或聚氨酯输液装置来制备和管理本品输液溶液。
(3)本品不能与其他药物混用。
本品最常见的不良反应和实验室异常(≥10%)为中性粒细胞减少、贫血、腹泻、恶心、疲劳、虚弱、呕吐、血尿、便秘、食欲减退、背痛和腹痛。
1.中性粒细胞计数≤1500 /mm3。
2.卡巴他赛或其他聚山梨酸酯80配制药物的严重超敏反应史。
3.严重肝功能损害(总胆红素>3×ULN)。
20°C至25°C室温下储存
成人患者
卡巴他赛主要通过CYP3A代谢,强CYP3A抑制剂(如酮康唑、伊曲康唑、克拉霉素、阿他那韦、茚地那韦、奈法唑酮、奈非那韦、利托那韦、沙奎那韦、泰利霉素、伏立康唑)可增加卡巴他赛的血浆浓度,避免与强CYP3A抑制剂同时给药,如果患者需要联合使用强CYP3A抑制剂,可以考虑减少25%的本品剂量。
36个月
注射剂
法国赛诺菲
本品的主要化学成分卡巴它赛,其化学结构式如下:
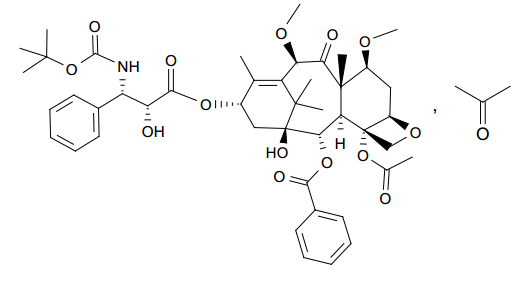
卡巴他赛注射液为透明的黄色到棕黄色的粘性溶液,稀释剂13%(w/w)乙醇水溶液为无色透明溶液。
中性粒细胞≤1500/mm3的患者禁用本品,密切监测血红蛋白<10g/dL的患者。
在仅由研究者自行决定给药粒细胞集落刺激因子的TROPIC试验中,5例(1.3%)患者死于中性粒细胞减少感染(败血症或感染性休克),其中4例患者在治疗的前30天死亡,另有1例患者死亡归因于中性粒细胞减少症,但无感染记录,22例(6%)患者因中性粒细胞减少、发热性中性粒细胞减少、感染或败血症而停止本品治疗,在随机试验中,接受本品治疗的患者中有82%发生3-4级中性粒细胞减少。
①在比较本品两种剂量的PROSELICA试验中,不允许使用粒细胞集落刺激因子进行初级预防,但可以在中性粒细胞减少症发生后根据研究者的判断给予,20mg/m2组8例(1%)和25mg/m2组15例(3%)死于感染,其中,20mg/m2组的4例死亡和25 mg/m2组的8例死亡发生在治疗的前30天内,临床重要的中性粒细胞减少相关事件发生,包括发热性中性粒细胞减少(20mg/m2组2.1%,25mg/m2组9.2%)、中性粒细胞减少感染/败血症(20mg/m2组2.1%,25mg/m2组6.4%)和中性粒细胞减少死亡(20mg/m2组0.3%,25mg/m2组0.7%)。
②接受本品20mg/m2的患者报告的感染不良反应较少,20mg/m2组有160例患者(28%)出现1-4级感染,25mg/m2组有227例患者(38%)出现1-4级感染,20mg/m2组有57例(10%)发生3-4级感染,25mg/m2组有120例(20%)发生感染。
①在CARD试验中,本品25mg/m2与粒细胞集落刺激因子的初级预防一起使用,1例患者(0.8%)在治疗的前30天内死于败血症,33例(26%)患者出现1-4级中性粒细胞减少相关不良反应,3-4级中性粒细胞减少26例(21%),临床重要的中性粒细胞减少相关事件发生,包括发热性中性粒细胞减少(3.2%)、中性粒细胞减少感染/败血症(0.8%)和中性粒细胞减少死亡(0.8%)。
②基于粒细胞集落刺激因子的使用指南和本品的不良反应,推荐对具有高风险临床特征(老年患者、不良表现、既往发热性中性粒细胞减少、既往广泛放疗、营养状况不良或其他严重合并症)的患者进行粒细胞集落刺激因子的初级预防,这些患者易因长期中性粒细胞减少而增加并发症,在所有接受本品25mg/m2的患者中考虑粒细胞集落刺激因子一级预防。
③在第一个治疗周期内和之后的每个治疗周期之前,必须每周监测全血细胞计数,以便在需要时调整剂量。
(1)在一项随机试验(TROPIC)中,2%(3/131)<65岁的患者和6%(15/240)≥65岁的患者在最后一次服用本品后30天内死于疾病进展以外的原因,≥65岁的患者更容易出现某些不良反应,包括中性粒细胞减少症和发热性中性粒细胞减少症,3-4级不良反应的发生率在≥65岁的患者中高于年轻患者,中性粒细胞减少症(87%对74%)和发热性中性粒细胞减少症(8%对6%)。
(2)在一项比较两种剂量本品的随机临床试验(PROSELICA)中,20mg/m2组的0.7%(4/580)患者和25mg/m2组的1.3%(8/595)患者在开始使用本品后30天内因感染而死亡,所有患者年龄均>60岁,在PROSELICA试验中,20mg/m2组中,3%(5/178)<65岁的患者和2%(9/402)≥65岁的患者在最后一次本品剂量后30天内死于疾病进展以外的原因,在25mg/m2组,2%(3/175)<65岁的患者和5%(20/420)≥65岁的患者在最后一次本品剂量后30天内死于疾病进展以外的原因。
(3)在CARD试验中,0.8%(1/126)的75岁以上患者在开始使用本品后30天内因感染死亡,2.4%(3/126)的患者在最后一次给药后30天内死于疾病进展以外的原因,所有患者年龄均>75岁。
(1)在开始注射本品后几分钟内可能发生过敏反应,因此应提供治疗低血压和支气管痉挛的设施和设备,可发生严重的过敏反应,包括全身皮疹/红斑、低血压和支气管痉挛。
(2)在开始注射本品之前,对所有患者进行预用药,密切观察患者的过敏反应,特别是在第一次和第二次输注时,,严重的过敏反应需要立即停止输注和适当的治疗,对卡巴他赛或其他聚山梨酸酯80配制的药物有严重过敏反应史的患者禁用本品。
(1)有时可能出现恶心、呕吐和严重腹泻,随机临床试验中出现与腹泻和电解质失衡相关的死亡,严重腹泻和电解质失衡可能需要强化措施,建议预防止吐,根据需要给病人补液、止泻或止吐药物,如果患者出现≥3级腹泻,可能需要延迟治疗或减少剂量。
(2)胃肠道(GI)出血和穿孔、肠梗阻、小肠结肠炎、中性粒细胞减少性小肠结肠炎,包括致命的结果,已在本品治疗的患者中报道,中性粒细胞减少、年龄、类固醇使用、同时使用非甾体抗炎药、抗血小板治疗或抗凝血药,以及既往有盆腔放疗、粘连、溃疡和胃肠道出血史的患者,可能会增加风险。
(3)腹痛和压痛、发热、持续性便秘、腹泻,伴或不伴中性粒细胞减少,可能是严重胃肠道毒性的早期表现,应及时评估和治疗,可能需要延迟或停用本品治疗。
(4)先前接受过放射治疗的患者胃肠道不良反应的发生率更高,在PROSELICA试验中,41%(297/732)接受过放疗的患者报告腹泻,27%(118/443)未接受过放疗的患者报告腹泻,在先前接受过放疗的患者中,与接受20mg/m2放疗的患者相比,接受25mg/m2放疗的患者报告腹泻的患者更多。
在随机临床试验(TROPIC)中,接受本品治疗的患者中有4%发生了任何级别的肾功能衰竭,其中包括4例死亡,大多数病例与败血症、脱水或梗阻性尿路病变有关,一些因肾衰竭而死亡的病例病因不明,应采取适当的措施,以确定肾功能衰竭的原因和积极治疗。
既往接受盆腔放疗的患者使用本品可出现膀胱炎、放射性膀胱炎和血尿,包括需要住院治疗的情况,在PROSELICA试验中,接受过放射治疗的患者中分别有1.2%和1.5%报告了膀胱炎和放射性膀胱炎,19.4%接受过放疗的患者报告有血尿,14.4%未接受过放疗的患者报告有血尿,放射召回引起的膀胱炎可能在本品治疗后期发生,监测先前接受盆腔放疗的患者在使用本品期间膀胱炎的体征和症状,严重出血性膀胱炎患者中断或停用本品,治疗严重出血性膀胱炎可能需要药物和/或手术支持治疗。
(1)据报道,间质性肺炎/肺炎、间质性肺病和急性呼吸窘迫综合征可能与致命结局有关,有潜在肺部疾病的患者发生这些事件的风险更高,急性呼吸窘迫综合征可在感染的情况下发生。
(2)如果出现新的或恶化的肺部症状,停止给药,密切监测、及时调查并适当治疗接受本品治疗的患者,考虑停药,必须仔细评估恢复本品治疗的益处。
卡巴他赛在肝脏被广泛代谢,严重肝功能损害(总胆红素>3×ULN)患者禁用本品,对于轻度(总胆红素>1~≤1.5×ULN或AST>1.5×ULN)和中度(总胆红素>1.5~≤3.0×ULN和任何AST)肝功能损害患者,应根据这些患者的耐受性数据减少剂量,轻度和中度肝功能损害患者使用本品时应谨慎并密切监测安全性。
根据动物繁殖研究的发现及其作用机制,给孕妇服用本品可能对胎儿造成伤害,目前尚无孕妇用药相关风险的可用数据,建议有生殖潜力的女性伴侣的男性在治疗期间和最后一次服用本品后3个月内采取有效避孕措施。
(以上参考自美国FDA药品说明书2021.02版)
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!