摘要:2022年9月9日—13日,第47届欧洲肿瘤内科学会(ESMO)在法国巴黎以线上和线下结合的方式成功举办,在此次会议上,公布了帕博利珠单抗(K药、可瑞达)联合阿昔替尼(阿西替尼、英利达)在意大利人群中,一线治疗转移性肾细胞癌(mRCC)的真实世界研究的最新数据。 2022年ESMO大会封面图而早在2019年4月19日,美国药监局(FDA)就已批准帕博利珠单抗联合阿昔替尼用于治疗晚期肾细胞癌,该联合
2022年9月9日—13日,第47届欧洲肿瘤内科学会(ESMO)在法国巴黎以线上和线下结合的方式成功举办,在此次会议上,公布了帕博利珠单抗(K药、可瑞达)联合阿昔替尼(阿西替尼、英利达)在意大利人群中,一线治疗转移性肾细胞癌(mRCC)的真实世界研究的最新数据。

而早在2019年4月19日,美国药监局(FDA)就已批准帕博利珠单抗联合阿昔替尼用于治疗晚期肾细胞癌,该联合疗法获批基于同年在《新英格兰医学杂志》上,首次公布的KeyNote-426研究中期分析的试验数据。
在开展KeyNote-426研究之前,已在Ib期临床试验中证实,帕博利珠单抗联合阿昔替尼治疗初治的晚期肾细胞癌患者具有抗肿瘤活性,但在该患者群体中,尚不明确该联合治疗是否优于单药舒尼替尼(索坦、sunitinib)治疗,因此Rini教授等人开展了此项III期临床试验。
在首次中期分析中,中位随访12.8个月后,治疗组(帕博利珠单抗联合阿昔替尼)比对照组(舒尼替尼)的中位无进展生存期(PFS)长4个月,治疗组的12个月生存率也优于对照组(89.9%vs.78.3%),治疗组的客观缓解率更是超对照组23.6%,高达59.5%,并且两组严重(≥3级)不良事件的发生率相当。
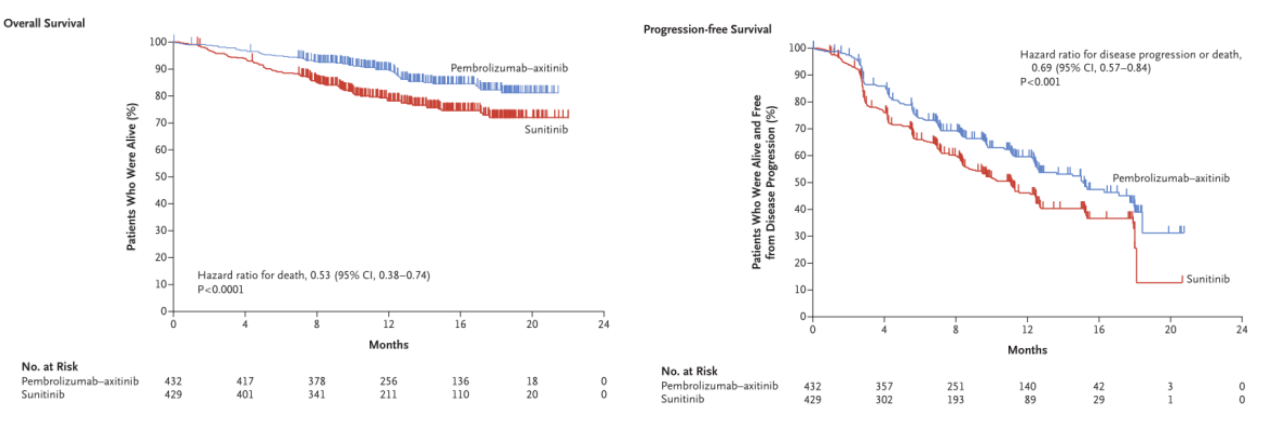
此次中期分析证实,在既往未接受过治疗的晚期肾细胞癌患者中,与舒尼替尼治疗相比,帕博利珠单抗联合阿昔替尼治疗显著延长了患者的总生存期和无进展生存期,并且获得了更高的缓解率[1],基于此研究结果,该联合治疗获批用于一线治疗晚期肾细胞癌,次年12月,该中期分析结果再次发表在《柳叶刀杂志》上[2]。
2021年美国临床肿瘤学会(ASCO)上,公布了KeyNote-426研究的最终分析结果,即中位随访42.8个月时的数据,这也是程序性死亡受体1(PD-1)抑制剂/程序性死亡配体1(PD-L1)抑制剂免疫疗法联合血管内皮生长因子(VEGF)/内皮生长因子受体(VEGFR )抑制剂一线治疗肾细胞癌最长的一次随访记录。

42个月时,治疗组(25.1%)的无进展生存率是对照组(10.6%)的两倍以上,客观缓解率和总生存率也高于对照组,治疗组的客观缓解率约为60%,其中六分之一的患者达到完全缓解,最常见的治疗相关的不良事件(发生率≥20%)为腹泻、高血压、疲劳和甲状腺功能减退,尽管随访时间延长,也未发现新的安全性信号[3]。
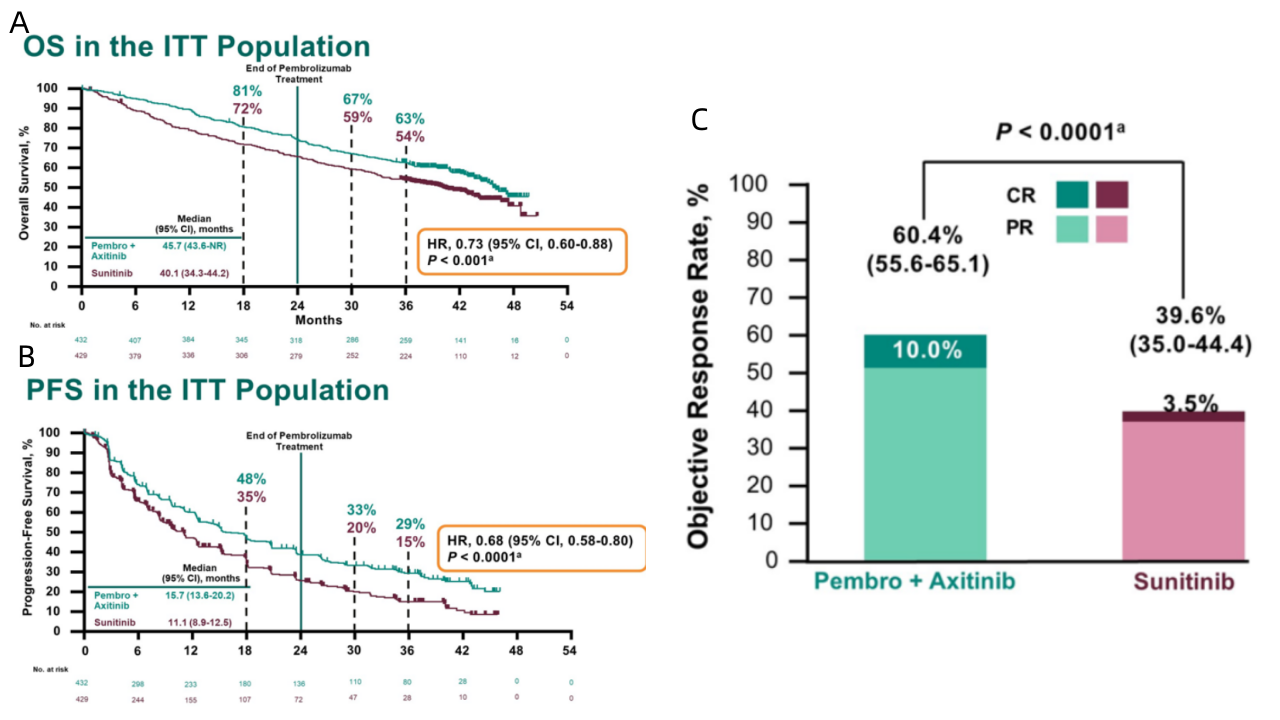
2022年美国临床肿瘤学会上,又公布了KeyNote-426研究中,治疗组和对照组接受后续治疗的进展分析[4],此处的无进展生存期为首次接受后续治疗直至任何原因导致死亡的中位时间,治疗组长达40.1个月,而对照组仅为27.7个月。
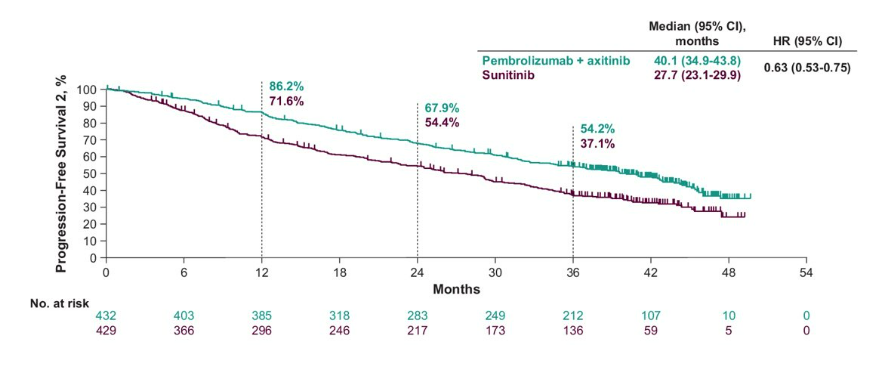
这两项分析进一步验证了帕博利珠单抗联合阿昔替尼一线治疗初治的晚期肾细胞癌具有可行性,可作为晚期肾细胞癌的标准治疗方案,并且在日本患者的亚组分析中,发现该亚组与全球人群的疗效和安全性基本一致[5],不存在种族差异,这意味着亚洲人群(包括中国患者)接受帕博利珠单抗联合阿昔替尼一线治疗可获得相同的治疗效果。
近期,刚刚落下帷幕的欧洲肿瘤内科学会(ESMO)上,公布了在意大利人群中,帕博利珠单抗联合阿昔替尼一线治疗转移性肾细胞癌的真实世界研究—ProPAXI研究的最新数据。该研究是一项前瞻性研究,共纳入了96例患者,其中绝大多数为肾透明细胞癌,并且40%以上都伴有转移,最常见是肺、淋巴结和骨转移,68%的患者接受了肾切除术。在对ProPAXI研究进行分析时,还有70%的患者正在接受治疗,其中65%仍为帕博利珠单抗联合阿昔替尼治疗,仅有25%出现疾病进展。
接受帕博利珠单抗联合阿昔替尼治疗的转移性肾细胞癌患者中,6个月的总生存率高达90%,12个月的总生存率仍为74%,6个月和12个月的无进展生存率分别为77%和60%。一半以上患者出现客观缓解,其中4%实现完全缓解,疾病控制率高达79%,26%的患者病情稳定。值得注意的是,接受联合治疗的患者有57%发生具有显著临床意义的不良事件,多见于肝脏(18%)、内分泌(14%)和胃肠道(16%),但只有28%的患者发生严重不良事件(≥3级)。此外,在中位随访8个月时,有16例患者死亡[6]。
此项在意大利人群中开展的真实世界研究证实,帕博利珠单抗联合阿昔替尼不仅一线治疗晚期肾细胞癌可使患者获益,一线治疗转移性肾细胞癌也具有良好的疗效和安全性。
2015年5月,阿昔替尼就已进入中国市场,2018年正式纳入我国医保目录,同年7月26日,中国药监局(NMPA)批准帕博利珠单抗在国内上市,截止到2022年9月,帕博利珠单抗仍未进入医保范围,而帕博利珠单抗联合阿昔替尼一线治疗晚期肾细胞癌仅在美国获批,我国药监局尚未批准这一适应症。
2021年7月30日,天津医科大学第二医院在美国临床试验数据库提交了新的试验申请,旨在中国人群中,评估帕博利珠单抗联合阿昔替尼作为局晚期、非转移性肾透明细胞癌新辅助治疗的初步疗效和安全性[7],虽然该临床试验并非是针对一线治疗,但此举措,预示着帕博利珠单抗联合阿昔替尼治疗肾细胞癌的确具有临床效益,并获得了临床专家和研究人员的重视,这意味着该联合方案有望在中国获得批准。目前,该临床试验尚未开始招募,有需要的患者可以多关注该试验的信息和进程,伟华也将持续跟进。
2025-10-31 16:07:13
2025-10-31 16:00:56
2025-10-31 11:32:04
2025-10-31 11:19:33
2025-10-31 11:06:29
2025-10-31 10:53:54
2025-10-31 10:45:37
2025-04-24 12:18:55
2025-02-12 13:30:09
2022-05-12 17:28:37