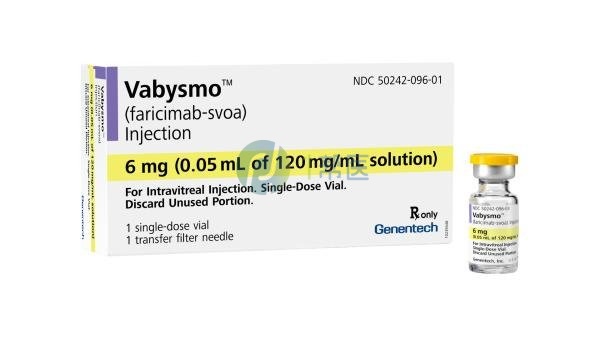
Vabysmo(法瑞西单抗)是全球首款眼科双抗,独特的作用机制在于能够同时靶向血管内皮生长因子A(VEGF-A)和血管生成素2(Ang-2)。通过对Ang-2和VEGF-A的双重抑制,Vabysmo可以降低血管通透性和炎症,抑制病理性血管生成并恢复血管稳定性。
药品称呼
别名:faricimab-svoa
全部名称:Vabysmo,faricimab-svoa
成分
faricimab-svoa
剂型
注射剂
性状
透明至乳白色、无色至棕黄色溶液
禁忌
1、眼部或眼周感染。
2、活动性眼内炎症。
3、超敏反应。
贮存方法
1、将Vabysmo(法瑞西单抗)储存在2°C至8°C(36°F至46°F)的冰箱中。
2、不要冻结。不要摇晃。
3、将小瓶放在原始纸箱中以避光。使用前,未开封的Vabysmo(法瑞西单抗)玻璃小瓶可在20°C至25°C(68°F至77°F)的室温下保存长达24小时。
4、确保在准备剂量后立即进行注射。
适用人群
黄斑变性、糖尿病性黄斑水肿患者
有效期
24个月
生产厂家
美国基因泰克
完整说明书详情:
适应症
VABYSMO是一种血管内皮生长因子(VEGF)和血管生成素-2(Ang-2)抑制剂,适用于治疗以下患者:
•新生血管(湿)年龄相关性黄斑变性(nAMD);
•糖尿病性黄斑水肿(DME)。
用法用量
用于玻璃体内注射。
•新生血管(湿)年龄相关性黄斑变性(nAMD)
oVABYSMO的建议剂量为6mg(0.05mL 120mg/mL溶液),前4剂每4周(约每28±7天,每月一次)进行玻璃体内注射,然后在8周和12周后进行光学相干断层扫描和视力评估,以告知是否在以下三种方案中的一种方案下通过玻璃体内注射给予6mg剂量:
1)第28周和第44周;
2)第24、36和48周;或者
3)第20、28、36和44周。
虽然与每8周给药一次相比,每4周给药一次VABYSMO未在大多数患者中显示出额外疗效,但一些患者可能需要在前4次给药后每4周(每月)给药一次。
应定期对患者进行评估。
•糖尿病性黄斑水肿(DME)
oVABYSMO建议按照以下两种剂量方案之一给药:
1)每4周(大约每28天±7天,每月一次)通过玻璃体内注射给药6毫克(0.05毫升120毫克/毫升溶液),持续时间为至少4剂。
如果在至少4次给药后,根据通过光学相干断层扫描测量的黄斑中心亚区厚度(CST)的水肿消退,则可以通过延长最多4周的间隔增量或减少来修改给药间隔根据CST和视力评估,最多8周间隔增量,直至第52周;或
2)前6剂可每4周给予6mg剂量的VABYSMO,随后在接下来的28周内每隔8周(2个月)通过玻璃体内注射给予6mg剂量。
尽管与每8周相比,当VABYSMO每4周给药一次时,大多数患者没有显示出额外的疗效,但一些患者在前4次给药后可能需要每4周(每月)给药一次。
应定期对患者进行评估。
不良反应
接受VABYSMO的患者报告的最常见不良反应(≥5%)是结膜出血(7%)。
禁忌
•眼部或眼周感染。
•活动性眼内炎症。
•超敏反应。
贮存方法
将VABYSMO储存在2°C至8°C(36°F至46°F)的冰箱中。不要冻结。不要摇晃。将小瓶放在原始纸箱中以避光。 使用前,未开封的VABYSMO玻璃小瓶可在20°C至25°C(68°F至77°F)的室温下保存长达24小时。确保在准备剂量后立即进行注射。
适用人群
黄斑变性、糖尿病性黄斑水肿患者
有效期
24个月
剂型
注射剂
生产厂家
美国基因泰克
成分
faricimab-svoa
性状
透明至乳白色、无色至棕黄色溶液
注意事项
•玻璃体内注射后可能会发生眼内炎和视网膜脱离。
应指导患者立即报告任何提示眼内炎或视网膜脱离的症状,以便及时进行适当的处理。
•玻璃体内注射后60分钟内观察到眼压升高。
•存在与VEGF抑制相关的动脉血栓栓塞事件(ATE)的潜在风险。
温馨提示
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!



 美国基因泰克
美国基因泰克  在线咨询
在线咨询 
 日本富士制药
日本富士制药
 德国勃林格殷格翰
德国勃林格殷格翰
 英国阿斯利康
英国阿斯利康
 用法用量
用法用量