维葡瑞(注射用维拉苷酶α)主要用于治疗1型戈谢病,这是一种常染色体隐性遗传代谢病,该药物通过特异性地补充患者体内缺乏的酶,减少葡萄糖脑苷脂在体内的贮积,改善患者的临床症状体征、维持正常的生长发育。
药品称呼
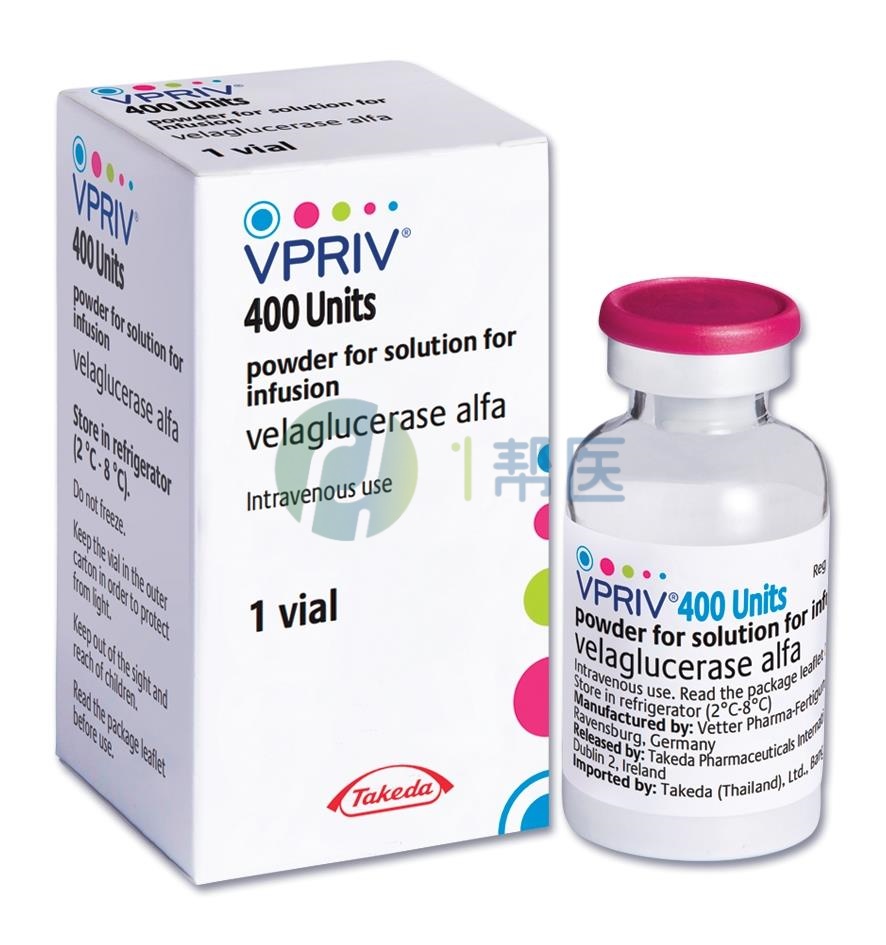
通用名称:注射用维拉苷酶α
商品名称:VPRIV
英文名称:velaglucerase alfa
中文名称:维葡瑞
全部名称:维葡瑞、注射用维拉苷酶α、VPRIV、velaglucerase alfa
剂型和规格
注射用:400 U无菌、白色至类白色冻干粉末,装于单剂量小瓶中,用于复溶和稀释。
特殊人群用药
1、妊娠
尚无或只有有限的孕妇使用维拉苷酶α的数据。给孕妇处方该药时应慎重。
2、哺乳期
尚无来自哺乳期妇女研究的数据。目前尚不清楚维拉苷酶α是否在人乳中分 泌。给哺乳妇女处方该药时应慎重。
3、儿童用药
已确定 VPRIV 用于4-17岁1型高雪氏症患者的酶替代治疗 (ERT) 的安全性和有效性。尚未确定VPRIV(维葡瑞)在4岁以下儿童患者中的疗效和安全性。
4、老年人用药
老年患者中的不良反应特征与之前在儿童和成人患者中观察到的一致。其他报告的临床经验未发现老年和年轻患者之间的反应差异。一般而言,考虑到潜在的合并症,老年患者的剂量选择应谨慎。
禁忌症
尚不明确
成分
本品主要成分为维拉西酶α。
性状
白色至类白色冻干粉末,装于单剂量小瓶中。
贮存方法
1、将VPRIV(维葡瑞)在2℃-8℃ (36℉-46℉) 下冷藏储存于原始纸箱中,避光。
2、请勿冷冻。
3、超过瓶上的失效日期后,请勿使用VPRIV(维葡瑞)。
有效期
36个月
生产厂家
Shire Human Genetic Therapies,Inc.
完整说明书详情:
通用名称:注射用维拉苷酶α
商品名称:VPRIV
英文名称:velaglucerase alfa
中文名称:维葡瑞
全部名称:维葡瑞、注射用维拉苷酶α、VPRIV、velaglucerase alfa
适应症
VPRIV(维葡瑞)适用于1型高雪氏症(戈谢病)患者的长期酶替代治疗 (ERT)。
剂型和规格
注射用:400 U无菌、白色至类白色冻干粉末,装于单剂量小瓶中,用于复溶和稀释。
用法用量
1、酶替代治疗初治患者的推荐起始剂量
VPRIV(维葡瑞)应在医疗保健专业人员的监督下给药。在初治成人和4岁及以上初治儿科患者中,推荐的 VPRIV 起始剂量为60单位/kg,每2周一次,60 min静脉输注给药。可根据每例患者治疗目标的实现和维持情况调整剂量。
2、从 Imigluce rase 转换为 VPRIV
目前正在接受稳定剂量伊米苷酶治疗1型高雪氏症的成人和4岁及以上儿童患者可以在伊米苷酶末次给药后2周以之前的伊米苷酶剂量开始VPRIV(维葡瑞)治疗,转换为VPRIV。VPRIV(维葡瑞)应在医疗保健专业人员的监督下通过 60 min 静脉输注给药。可根据每例患者治疗目标的实现和维持情况调整剂量。
3、VPRIV 冻干粉的复溶 r
VPRIV(维葡瑞)是一种冻干粉末,在静脉输注前需要使用无菌技术复溶和稀释。VPRIV(维葡瑞)应按以下方法制备:
(a)根据个体患者的体重和处方剂量确定待复溶的小瓶数量。
(b)将4.3 mL无菌注射用水 (USP) 注入含有VPRIV(维葡瑞)冻干粉的小瓶中。
(c)轻轻混合。请勿摇晃。复溶的VPRIV(维葡瑞)溶液 浓度为100 U/mL(4 mL溶液中含400U VPRIV)。
(d)如果需要额外的小瓶,重复步骤 (b) 和 (c)。
(e)目视检查小瓶中复溶的VPRIV(维葡瑞)溶液。溶液应澄清至略带乳光,无色。如果溶液变色或存在异物,请勿使用。
(f)使用单个注射器,从适当数量的小瓶中抽取计算剂量的药物。使用单独的注射器,从适合静脉给药的100 mL 0.9%氯化钠注射液袋中抽出空气。然后将计算的VPRIV(维葡瑞)剂量直接稀释于0.9%氯化钠注射液中。轻轻混合。请勿摇晃。偶尔可能发生轻微絮凝(描述为白色不规则形状颗粒)。轻微絮凝的稀释溶液可用于给药。
(g)由于VPRIV(维葡瑞)不含防腐剂,立即使用复溶的VPRIV(维葡瑞)溶液和稀释的VPRIV(维葡瑞)溶液。如果不可能立即使用,复溶的VPRIV(维葡瑞)溶液或稀释的VPRIV(维葡瑞)溶液可在2℃下储存长达24小时至ºC(36ºF-46ºF)。请勿冷冻和避光。在小瓶复溶后24小时内完成输注。
(h)小瓶仅供一名患者一次性使用。丢弃任何未使用的溶液。
4、重要给药说明
通过在线低蛋白结合0.2或0.22 µm过滤器在 60 min 内给予VPRIV(维葡瑞)稀释液。由于尚未评价VPRIV(维葡瑞)溶液与其他产品的相容性,因此不得在同一输液管路中与其他产品一起输注VPRIV(维葡瑞)。
不良反应
常见不良反应见下表:
不良反应ERT 初治N = 54
患者人数 (%)从伊米苷酶转换为 VPRIV;N = 40
患者人数 (%)
超敏反应*28 (52)9 (23)
头痛19 (35)12 (30)
头晕12 (22)3 (8)
发热12 (22)5 (13)
腹痛10 (19)6 (15)
背痛9 (17)7 (18)
关节疼痛(膝关节)8 (15)3 (8)
乏力/疲乏8 (15)5 (13)
活化部分凝血活酶时间延长6 (11)2 (5)
恶心3 (6)4 (10)
*表示认为与 VPRIV 输注相关并在 VPRIV 输注后24小时内发生的任何事件,包括1例过敏反应。
注意事项
严重速发型超敏反应(包括速发过敏反应)
在临床研究和上市后经验中发生了超敏反应,包括速发过敏反应 [参见不良反应]。超敏反应是临床研究中接受VPRIV(维葡瑞)治疗的患者最常见的不良反应。临床研究期间,患者在输注 VPRIV(维葡瑞)前未接受常规预防性用药。最常见的超敏反应症状为:头痛、头晕、低血压、高血压、恶心、疲乏/无力和发热/体温升高。
特殊人群用药
1、妊娠
尚无或只有有限的孕妇使用维拉苷酶α的数据。给孕妇处方该药时应慎重。
2、哺乳期
尚无来自哺乳期妇女研究的数据。目前尚不清楚维拉苷酶α是否在人乳中分 泌。给哺乳妇女处方该药时应慎重。
3、儿童用药
已确定 VPRIV 用于4-17岁1型高雪氏症患者的酶替代治疗 (ERT) 的安全性和有效性。尚未确定VPRIV(维葡瑞)在4岁以下儿童患者中的疗效和安全性。
4、老年人用药
老年患者中的不良反应特征与之前在儿童和成人患者中观察到的一致。其他报告的临床经验未发现老年和年轻患者之间的反应差异。一般而言,考虑到潜在的合并症,老年患者的剂量选择应谨慎。
禁忌症
无
成分
本品主要成分为维拉西酶α。
性状
白色至类白色冻干粉末,装于单剂量小瓶中。
贮存方法
1、将VPRIV(维葡瑞)在2℃-8℃ (36℉-46℉) 下冷藏储存于原始纸箱中,避光。
2、请勿冷冻。
3、超过瓶上的失效日期后,请勿使用VPRIV(维葡瑞)。
有效期
36个月
生产厂家
Shire Human Genetic Therapies,Inc.



 日本武田
日本武田  在线咨询
在线咨询 
 美国辉瑞
美国辉瑞
 德国默沙东
德国默沙东

 新西兰道格拉斯
新西兰道格拉斯 用法用量
用法用量