必妥维是一种复方制剂的抗病毒药物,其结合了三种不同的活性成分,通过不同的机制共同抑制人类免疫缺陷病毒1型(HIV-1)的复制,实现对HIV感染的有效治疗。
药品称呼
通用名称:bictegravir/emtricitabine/tenofovir alafenamide
商品名称:Biktarvy
英文名称:bictegravir/emtricitabine/tenofovir alafenamide
中文名称:必妥维
全部名称:必妥维、比克恩丙诺片、Biktarvy、bictegravir/emtricitabine/tenofovir alafenamide
剂型和规格
必妥维片剂有两种剂量:
1、50毫克/200毫克/25毫克片剂:50 毫克比特拉韦(BIC)(相当于52.5毫克比特拉韦钠)、200毫克恩曲他滨(FTC)和25毫克替诺福韦-阿拉非那胺(TAF)(相当于28毫克富马酸替诺福韦-阿拉非那胺)。 这些药片呈紫褐色,胶囊状,薄膜包衣,一面印有"GSI"字样,另一面印有"9883"字样。
2、30毫克/120毫克/15毫克片剂:30毫克BIC(相当于31.5毫克比特拉韦钠)、120毫克FTC和15毫克TAF(相当于16.8毫克富马酸替诺福韦-阿拉非那胺)。这些药片呈粉红色,胶囊状,薄膜包衣,一面印有"GSI"字样,另一面印有"B"字样。
特殊人群用药
1、妊娠期
目前尚无足够的女性妊娠期使用必妥维的数据来说明药物相关的出生缺陷和流产风险。另一种整合酶抑制剂多罗替拉韦(Dolutegravir)与神经管畸形(NTD)有关。与有生育能力的人讨论使用必妥维的获益风险,尤其是在计划怀孕的情况下。在妊娠期间使用必妥维只在向APR报告的少数女性中进行了评估;因此,APR的BIC数据不足以充分评估重大出生缺陷的风险。使用含有TAF或FTC的其他药物产品治疗孕妇的报告有助于APR对这些成分进行总体风险评估。APR的现有数据显示,与美国大都会亚特兰大先天缺陷计划(MACDP)参考人群中2.7%的重大先天缺陷率相比,FTC或TAF的重大先天缺陷总体风险在统计学上没有显著差异。APR 中未报告流产率。据估计,美国普通人群中临床认可的妊娠流产率为 15-20%。
在一项产前/产后发育研究中,从妊娠第6天到哺乳/产后第24天,向妊娠动物口服BIC(最高300毫克/千克/天)。在从出生前(子宫内)到哺乳期每天暴露于母体和幼仔暴露量(AUC)的后代中,未观察到显著的不良作用,母体和幼仔暴露量(AUC)分别约是人暴露量的30倍和11倍(RHD)。
2、哺乳期
目前尚不清楚必妥维或必妥维的所有成分是否存在于母乳中、是否影响母乳产量或是否对母乳喂养的婴儿产生影响。根据已公布的数据,已显示FTC存在于人类母乳中。在哺乳期动物幼仔的血浆中检测到了BIC病,这很可能是由于乳汁中存在BIC,并且在TDF给药后,已显示在泌乳动物乳汁中存在替诺福韦。尚不清楚动物乳汁中是否含有TAF。
母乳喂养的潜在风险包括:(1)HIV-1传播给HIV-1阴性婴儿;(2)在HIV-1阳性婴儿中产生病毒抗性;(3)类似于在成人中所见的母乳喂养婴儿中的不良反应。
3、儿童使用
必妥维作为治疗体重至少为14千克的1型人类免疫缺陷病毒(HIV-1)感染儿童患者的全套方案,其安全性和有效性均已得到证实:
1)无抗逆转录病毒治疗史或
2)对于病毒学抑制(HIV-1 RNA低于50拷贝/毫升)、使用稳定的抗逆转录病毒疗法且对比特拉韦或替诺福韦没有已知或疑似耐药性的患者,用于替代当前的抗逆转录病毒疗法。
在体重至少为14千克的儿童患者中使用必妥维有以下依据:
1)成人试验
2)在三个年龄组的病毒抑制儿科受试者中进行的开放标签试验
队列1:12至18岁,体重至少35千克,接受必妥维治疗直至第48周(N=50),
队列2:6至12岁,体重至少25千克,接受必妥维治疗直至第24周(N=50),和
队列3:年龄至少2岁,体重至少14至小于25千克,接受必妥维治疗直至第24周(N=22)。未招募2岁以下的儿童受试者;在招募时年龄为3岁的6名儿童受试者中,3名受试者的体重在14至小于15千克之间。
在这些儿童受试者中,必妥维的安全性和疗效与在成人受试者中相似,必妥维各组分的暴露量在临床上没有显著变化。
尚未确定在体重小于14千克的儿童患者中使用必妥维的安全性和有效性。
4、老年用药
在病毒学抑制受试者中进行的临床试验(试验4449、1844和1878)包括111名接受必妥维治疗的65岁及以上受试者,其中包括86名来自开放标签、单臂试验的65岁及以上受试者,这些受试者从以前的抗逆转录病毒治疗方案转换为必妥维。在这些试验中接受必妥维治疗的患者总数中,100名(90%)为65至74岁,11名(10%)为75至84岁。未观察到老年受试者与18岁至小于65岁的成人之间在安全性或有效性方面的总体差异,且其他已报告的临床经验未发现老年患者与年轻患者之间的应答差异,但不能排除某些老年人具有更大的敏感性。
5、肾功能损害
在病毒学抑制的ESRD(估计肌酐清除率低于15毫升/分钟)成人慢性血液透析患者中,采用FTC+TAF联合埃替拉韦和cobicistat作为固定剂量复方片剂进行治疗,为期96周(N=55),在单臂、开放标签试验(试验1825)中评估了FTC和TAF(必妥维的组分)的药代动力学、安全性、病毒学和免疫应答。在试验1825的延长期,10名病毒学抑制的受试者转而接受必妥维治疗,所有受试者均保持病毒学抑制48周。
对于估计肌酐清除率大于或等于30毫升/分钟的患者,或接受慢性血液透析的病毒抑制成人(估计肌酐清除率低于15毫升/分钟),不建议调整必妥维的剂量。在血液透析日,在完成血液透析治疗后服用每日剂量的必妥维。
Cockcroft-Gault 法估计肌酐清除率低于30毫升/分钟的患者,或未接受慢性透析的ESRD患者(估计肌酐清除率低于15毫升/分钟),或无抗逆转录病毒治疗史且接受慢性透析的ESRD患者,不推荐使用必妥维,因为必妥维在这些人群中的安全性和/或疗效尚未得到证实。
6、肝功能损害
对于轻度(Child-Pugh类别A)或中度(Child-Pugh类别B)肝功能损害的患者,不建议调整必妥维的剂量。尚未在严重肝功能损害(Child-Pugh C类)患者中进行必妥维研究。
因此,不建议将必妥维用于严重肝功能损害患者。
禁忌症
必妥维严禁与以下药物同时服用:
1、多非利特,因为可能会导致多非利特血浆浓度升高以及相关的严重和/或危及生命的事件。
2、利福平,因为BIC血浆浓度降低,这可能会导致失去治疗效果并产生对必妥维的耐药性。
药物相互作用
1、其他抗逆转录病毒药物
因为必妥维是一个完整的方案,所以不建议与其他抗逆转录病毒药物联合用药治疗HIV-1感染。未提供关于与其他抗逆转录病毒药物潜在的药物间相互作用的全面信息,因为合用HIV-1抗逆转录病毒疗法的安全性和疗效未知。
2、必妥维对其他药物的潜在影响
BIC在体外可抑制有机阳离子转运体2 (OCT2) 和多药与毒素挤压转运体1 (MATE1)。与作为OCT2和MATE1底物的药物(如多非利特)同时服用必妥维,可能会增加这两种药物的血浆浓度。
3、其他药物对必妥维一种或多种成份的潜在影响
BIC是CYP3A和UGT1A1的底物。CYP3A的强诱导剂和UGT1A1的诱导剂药物可显著降低BIC血浆浓度,这可能导致必妥维疗效丧失和耐药性产生。
与CYP3A强抑制剂和UGT1A1抑制剂一起使用必妥维可能会显著增加BIC血浆浓度。
TAF是P-糖蛋白(P-gp)和乳腺癌耐药蛋白(BCRP)的底物。同时服用抑制P-gp和BCRP的药物可能会增加TAF的吸收和血浆浓度。诱导P-gp活性的药物联合给药预计会降低TAF吸收,导致TAF血浆浓度降低,这可能导致必妥维疗效丧失和耐药性产生。
4、影响肾功能的药物
由于FTC和替诺福韦主要通过肾小球滤过和主动肾小管分泌的组合由肾脏排泄,因此必妥维与降低肾功能或竞争主动肾小管分泌的药物联合用药可能会增加FTC、替诺福韦和其他经肾脏清除的药物的浓度,从而可能增加不良反应的风险。可通过肾小管主动分泌清除的药物包括但不限于阿昔洛韦、西多福韦、更昔洛韦、万乃洛韦、缬更昔洛韦、氨基糖苷类(如庆大霉素)和高剂量或多种NSAIDs。
5、已确定的和潜在的显著药物相互作用
下表列出了已确定或潜在具有临床意义的药物相互作用,并推荐了预防或管理策略。所述药物相互作用基于对必妥维、必妥维的成分(BIC、FTC和TAF)作为单独制剂进行的研究,或者是必妥维可能发生的药物相互作用。
表:已确定的和潜在的显著a药物相互作用:建议改变方案
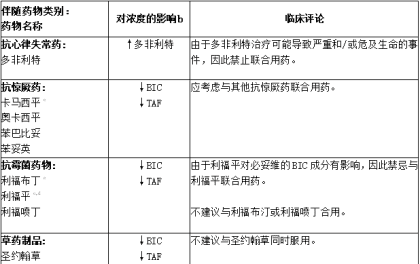
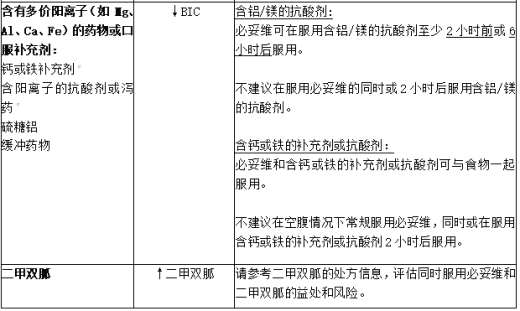
a.表格不包括所有内容。
b.↑ = Increase, ↓ = Decrease.
c.对必妥维或其成分作为单独药物进行了药物相互作用研究。
d.CYP3A 和 P-gp 的强诱导剂,以及 UGT1A1 的诱导剂。
e.圣约翰草的诱导效力可能因制剂不同而有很大差异。
6、与必妥维无明显临床相互作用的药物
根据对必妥维或必妥维成分进行的药物相互作用研究,当必妥维与下列药物联用时,未观察到有临床意义的药物相互作用:乙炔雌二醇、依地帕韦/索巴韦、咪达唑仑、诺格估计、舍曲林、索巴韦、索巴韦/韦帕斯韦和索巴韦/韦帕斯韦/沃西拉普韦。
药物过量
尚无患者过量服用必妥维的数据。如果发生药物过量,应监测患者是否出现中毒症状。必妥维服用过量的治疗包括一般支持措施,包括监测生命体征和观察患者的临床状况。
血液透析治疗可在服用四氯化碳后1.5小时内开始的3小时透析期内清除约30%的四氯化碳剂量(血流量为400毫升/分钟,透析液流量为600毫升/分钟)。目前尚不清楚腹膜透析能否清除四氯化碳。
血液透析可有效去除替诺福韦,提取系数约为54%。
成分
活性成分:比替拉韦、恩曲他滨和替诺福韦酰胺。
非活性成分:十碳纤维素钠、硬脂酸镁和微晶纤维素。
薄膜包衣:氧化铁黑、氧化铁红、聚乙二醇、聚乙烯醇、滑石粉和二氧化钛。
性状
片剂
贮存方法
1、将必妥维药瓶储存在30°C以下。
2、将必妥维药瓶关紧。
3、必妥维内含一个干燥剂包,可保持药物干燥(防止受潮)。将干燥剂包保存在瓶中。不要食用干燥剂包。
4、将必妥维吸塑包装储存在20°C至25°C的室温下。
5、将必妥维保存在其原装瓶或泡罩包装中。
6、必妥维采用儿童安全包装。
7、将必妥维和所有药物放在儿童拿不到的地方。
生产厂家
吉利德科学



 美国吉利德
美国吉利德  在线咨询
在线咨询 
 美国强生
美国强生
 瑞士诺华
瑞士诺华
 埃及亚历山大药厂
埃及亚历山大药厂
 用法用量
用法用量