吉西他滨的作用机制与阿糖胞苷相似,进入人体内后由脱氧胞嘧啶激酶活化,由胞嘧啶核苷脱氨酶代谢。其主要代谢物在细胞内掺入DNA,主要作用于G1/S期。吉西他滨还能抑制核苷酸还原酶,导致细胞内脱氧核苷三磷酸酯减少。
药品称呼
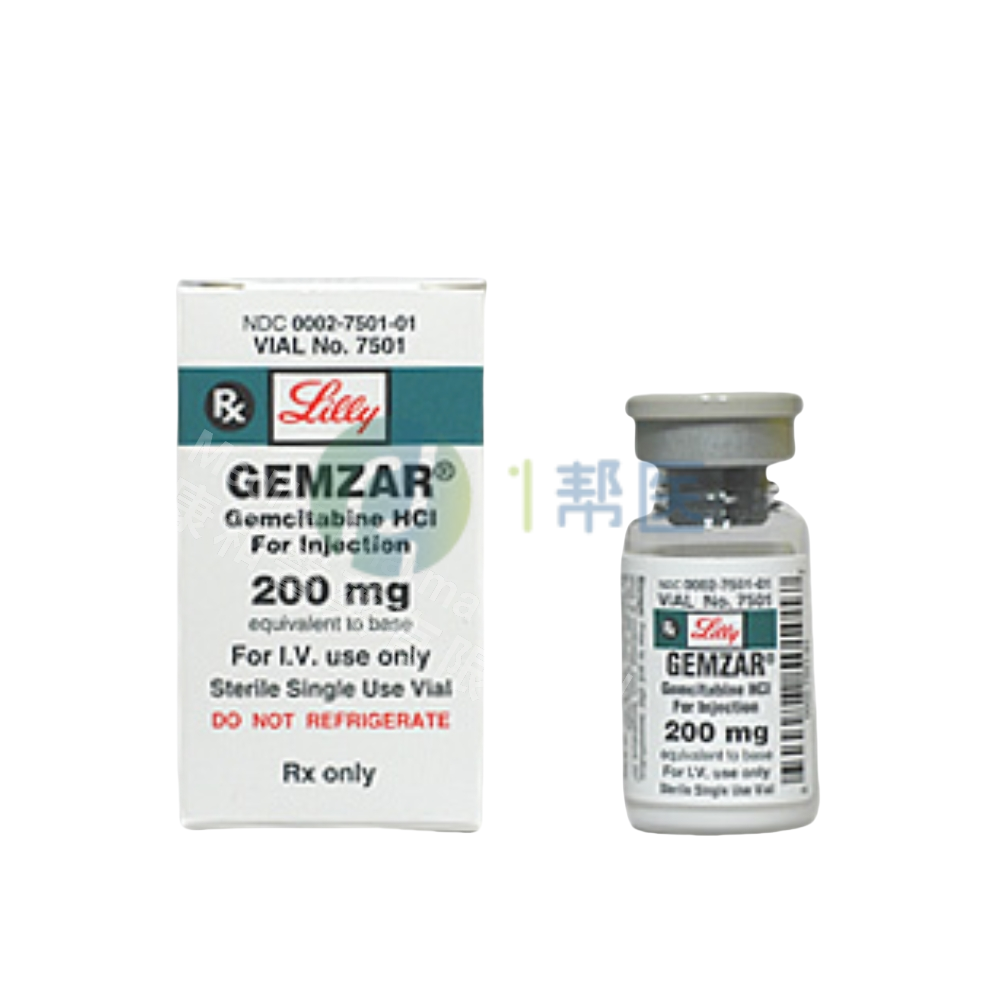
通用名:Gemcitabine
商品名:Gemzar
全部名称:吉西他滨,泽菲,Gemcitabine,Gemcite,Gemzar, Infugem
禁忌
已知对吉西他滨过敏的患者。
妊娠及哺乳期妇女禁用。
贮藏
储存在受控室温20°C至25°C(68°F至77°F); 允许在15°C和30°C(59°F和86°F)之间进行偏移
作用机制
吉西他滨杀死经历DNA合成的细胞并阻断细胞通过G1/S期边界的进展。
吉西他滨被核苷激酶代谢为二磷酸(dFdCDP)和三磷酸(dFdCTP)核苷。
吉西他滨二磷酸抑制核糖核苷酸还原酶,这种酶负责催化产生脱氧核苷三磷酸以进行DNA合成的反应,导致脱氧核苷酸浓度降低,包括dCTP。吉西他滨三磷酸与dCTP竞争结合到DNA中。通过二磷酸的作用降低细胞内dCTP浓度增强了吉西他滨三磷酸到DNA中的掺入(自增强)。在将吉西他滨核苷酸掺入DNA后,仅向生长的DNA链中加入一个额外的核苷酸,最终导致凋亡细胞死亡的开始。
安全与疗效
吉西他滨具有抗瘤谱广、不良反应少等特点,近年来的数项大型Ⅲ期研究显示其单药或联合其他化疗药物用于晚期乳腺癌具有良好疗效,目前已成为国内外指南推荐用于晚期乳腺癌的首选化疗药物之一。
一项Ⅲ期研究中期分析(摘要号5536)报道,449例经手术切除的Ⅰc~Ⅳ期卵巢上皮癌、原发性腹膜癌或输卵管癌患者随机使用GC方案或紫杉醇 卡铂(TC)方案化疗,之后均选择性辅以紫杉醇巩固化疗。两组患者客观缓解率(ORR)和疾病控制率(DCR)无明显差异,且毒性反应与既往临床经验一致。结果表明GC方案治疗多种病理类型的卵巢癌可能与TC方案具有同样的疗效,GC可能成为一线治疗新选择。
完整说明书详见:
生产厂家
美国礼来Lilly
成分
2-脱氧-2,2-盐酸二氟脱氧胞苷
性状
白色疏松块状物。
适应症
与卡铂联合用于治疗在铂类疗法完成后至少6个月复发的晚期卵巢癌。
与紫杉醇联合用于在先前使用含蒽环类药物的辅助化疗失败后对转移性乳腺癌进行一线治疗,除非临床上使用蒽环类抗生素。
与顺铂联合用于治疗非小细胞肺癌。
作为治疗胰腺癌的单一药剂。
用法用量
成人推荐吉西他滨剂量为1000mg/m2静脉滴注30分钟,每周一次,连续三周,随后休息一周,每四周重复一次。
依据病人的毒性反应相应减少剂量。
高龄患者:65岁以上的高龄患者也能很好耐受。
尽管年龄对吉西他滨的清除率和半衰期有影响,但并没有证据表明高龄患者需要调整剂量。
不良反应
单剂(≥20%)最常见的不良反应:恶心/呕吐,贫血,天冬氨酸氨基转移酶(AST)增加,丙氨酸氨基转移酶(ALT)增加,中性粒细胞减少,碱性磷酸酶升高,蛋白尿,发热,血尿,皮疹,血小板减少,呼吸困难和水肿。
禁忌
已知对吉西他滨过敏的患者。
妊娠及哺乳期妇女禁用。
贮存方法
储存在受控室温20°C至25°C(68°F至77°F); 允许在15°C和30°C(59°F和86°F)之间进行偏移
适用人群
与卡铂联合用于治疗在铂类疗法完成后至少6个月复发的晚期卵巢癌。 与紫杉醇联合用于在先前使用含蒽环类药物的辅助化疗失败后对转移性乳腺癌进行一线治疗,除非临床上使用蒽环类抗生素。 与顺铂联合用于治疗非小细胞肺癌。 作为治疗胰腺癌的单一药剂。
有效期
24个月
剂型
冻干粉
注意事项
附表依赖性毒性:输注时间超过60分钟或加药时间超过一周,毒性增加。
骨髓抑制:在每个周期之前监测骨髓抑制,减少或停止严重骨髓抑制的剂量。
肺部毒性和呼吸衰竭:因不明原因的呼吸困难或其他严重肺毒性证据而停止使用GEMZAR。
溶血性尿毒症综合征(HUS):在开始前和治疗期间监测肾功能。
停止GEMZAR治疗HUS严重肾功能损害。
肝毒性:在开始和治疗期间监测肝功能。
停止GEMZAR治疗严重的肝毒性。
胚胎-胎儿毒性:可能导致胎儿伤害。
建议有生育潜力的雌性和雌性使用有效的避孕措施。
放射治疗恶化毒性:放射治疗期间或放射治疗7天内可能导致严重和危及生命的毒性。
毛细血管渗漏综合征:停止使用GEMZAR。
后部可逆性脑病综合征(PRES):停止GEMZAR。



 美国礼来Lilly
美国礼来Lilly  在线咨询
在线咨询 

 英国阿斯利康
英国阿斯利康
 日本卫材
日本卫材
 美国Mirati
美国Mirati 用法用量
用法用量