Vyxeos是由阿糖胞苷和柔红霉素按照5:1的比例组合而成的脂质体药物。这种纳米级脂质体递送载体可增强疗效,同时限制了单独服用每种药物的风险。与单独接受这两种药物治疗相比,Vyxeos可增加协同作用,减少拮抗作用,显著提高化疗效果,延长患者的生存时间。
药品称呼
通用名:Daunorubicin and cytarabine
商品名:Vyxeos
全部名称:柔红霉素/阿糖胞苷复方冻干粉注射剂,Vyxeos,Daunorubicin and cytarabine
禁忌
禁止使用其他含有柔红霉素和阿糖胞苷的产品替换本品。
对柔红霉素,阿糖胞苷或制剂中任何成分过敏。
注意事项
(1)严重或致命出血伴持续性血小板减少:在恢复正常前需监测血细胞计数。
(2)心脏毒性:不建议心脏功能差的患者使用VYXEOS。心脏功能受损的患者应终止使用VYXEOS,除非使用VYXEOS利大于弊。
(3)若发生重度或危及生命的过敏反应,停止使用VYXEOS,使用标准处理方法给予治疗,监测直到症状体征缓解。
(4)柔红霉素可能导致药物溢出部位的局部组织坏死,输注时需要注意监测。
(5)胚胎毒性:可能致胎儿危害。告知患者对胎儿的潜在风险和使用有效避孕。
贮藏
将未重构的VYXEOS样品瓶存放在冰箱中,温度为2°C至8°C(36°F至46°F),直立。
小瓶应存放在其原始纸箱中以防光。
作用机制
用于注射的VYXEOS(柔红霉素和阿糖胞苷)脂质体是柔红霉素和阿糖胞苷的脂质体制剂,其固定的摩尔比为1:5。已显示柔红霉素:阿糖胞苷的1:5摩尔比在体外和鼠模型中杀死白血病细胞具有协同作用。
柔红霉素具有抗有丝分裂和细胞毒活性,其特征在于DNA形成,抑制拓扑异构酶II活性,抑制DNA聚合酶活性,影响基因表达的调节和DNA损伤自由基。阿糖胞苷是细胞周期阶段特异性抗肿瘤剂,仅在细胞分裂的S期期间影响细胞。阿糖胞苷通过抑制DNA聚合酶起作用。
基于动物数据,脂质体进入并持续存在于骨髓中,在那里它们被骨髓细胞完整地取出。在携带白血病的小鼠中,脂质体被白血病细胞摄取的程度大于正常骨髓细胞。细胞内化后,脂质体经历降解,在细胞内环境中释放出阿糖胞苷和柔红霉素。
安全与疗效
Vyxeos,原名为CPX-351,是阿糖胞苷和柔红霉素按照 5:1的比例组合的脂质体,可增加协同作用,减少拮抗作用。
在一项重要的3期临床试验中,研究人员比较了Vyxeos和单用“7+3”方案(柔红霉素及阿糖胞苷)对309 名新诊断的t-AML 或 AML-MRC患者的安全性和有效性。
主要终点是总生存期(OS)。结果显示,Vyxeos表现出显著的优势:中位OS为9.6个月,而对照组为5.9个月(p = 0.005;HR=0.69;95%CI,0.52 - 0.90);完全缓解率为38% vs 26%,有统计学意义的改善(P =0. 036);整体上,30天的死亡率为6% vs 11%。
Vyxeos(cytarabine/ daunorubicin liposomal)
Indication
VYXEOS (daunorubicin and cytarabine) liposome for injection 44 mg/100 mg is indicated for the treatment of adults with newly-diagnosed therapy-related acute myeloid leukemia (t-AML) or AML with myelodysplasia-related changes (AML-MRC).
Important Safety Information
WARNING:
DO NOT INTERCHANGE WITH OTHER DAUNORUBICIN AND/OR CYTARABINE-CONTAINING PRODUCTS
VYXEOS has different dosage recommendations than daunorubicin hydrochloride injection, cytarabine injection, daunorubicin citrate liposome injection, and cytarabine liposome injection. Verify drug name and dose prior to preparation and administration to avoid dosing errors.
Contraindications
VYXEOS is contraindicated in patients with a history of serious hypersensitivity reactions to cytarabine, daunorubicin, or any component of the formulation.
Warnings and Precautions
Hemorrhage
Serious or fatal hemorrhage events, including fatal CNS hemorrhages, associated with prolonged thrombocytopenia, have occurred with VYXEOS. The overall incidence (grade 1-5) of hemorrhagic events was 74% in the VYXEOS arm and 56% in the control arm. The most frequently reported hemorrhagic event was epistaxis (36% in VYXEOS arm and 18% in control arm). Grade 3 or greater events occurred in 12% of VYXEOS-treated patients and in 8% of patients in the control arm. Fatal treatment-emergent CNS hemorrhage not in the setting of progressive disease occurred in 2% of patients in the VYXEOS arm and in 0.7% of patients in the control arm. Monitor blood counts regularly and administer platelet transfusion support as required.
Cardiotoxicity
VYXEOS contains daunorubicin, which has a known risk of cardiotoxicity. This risk may be increased in patients with prior anthracycline therapy, preexisting cardiac disease, previous radiotherapy to the mediastinum, or concomitant use of cardiotoxic drugs. Assess cardiac function prior to VYXEOS treatment and repeat prior to consolidation and as clinically required. Discontinue VYXEOS in patients with impaired cardiac function unless the benefit of initiating or continuing treatment outweighs the risk. VYXEOS is not recommended in patients with cardiac function that is less than normal.
Total cumulative doses of non-liposomal daunorubicin greater than 550 mg/m2 have been associated with an increased incidence of drug-induced congestive heart failure. The tolerable limit appears lower (400 mg/m2) in patients who received radiation therapy to the mediastinum. Calculate the lifetime cumulative anthracycline exposure prior to each cycle of VYXEOS. VYXEOS is not recommended in patients whose lifetime anthracycline exposure has reached the maximum cumulative limit.
Hypersensitivity Reactions
Serious or fatal hypersensitivity reactions, including anaphylactic reactions, have been reported with daunorubicin and cytarabine. Monitor patients for hypersensitivity reactions. If a mild or moderate hypersensitivity reaction occurs, interrupt or slow the rate of infusion with VYXEOS and manage symptoms. If a severe or life-threatening hypersensitivity reaction occurs, discontinue VYXEOS permanently, treat the symptoms, and monitor until symptoms resolve.
Copper Overload
VYXEOS contains copper. Consult with a hepatologist and nephrologist with expertise in managing acute copper toxicity in patients with Wilson’s disease treated with VYXEOS. Monitor total serum copper, serum non-ceruloplasmin-bound copper, 24-hour urine copper levels, and serial neuropsychological examinations during VYXEOS treatment in patients with Wilson’s disease or other copper-related metabolic disorders. Use only if the benefits outweigh the risks. Discontinue in patients with signs or symptoms of acute copper toxicity.
Tissue Necrosis
Daunorubicin has been associated with severe local tissue necrosis at the site of drug extravasation. Administer VYXEOS by the intravenous route only. Do not administer by intramuscular or subcutaneous route.
Embryo-Fetal Toxicity
VYXEOS can cause embryo-fetal harm when administered to a pregnant woman. Patients should avoid becoming pregnant while taking VYXEOS. If VYXEOS is used during pregnancy or if the patient becomes pregnant while taking VYXEOS, apprise the patient of the potential risk to a fetus. Advise females and males of reproductive potential to use effective contraception during treatment and for 6 months following the last dose of VYXEOS.
Most Common Adverse Reactions
The most common adverse reactions (incidence ≥25%) were hemorrhagic events (74%), febrile neutropenia (70%), rash (56%), edema (55%), nausea (49%), mucositis (48%), diarrhea (48%), constipation (42%), musculoskeletal pain (43%), fatigue (39%), abdominal pain (36%), dyspnea (36%), headache (35%), cough (35%), decreased appetite (33%), arrhythmia (31%), pneumonia (31%), bacteremia (29%), chills (27%), sleep disorders (26%), and vomiting (25%).
完整说明书详情:
适应症
适用于治疗新诊断的治疗相关的急性骨髓性白血病(AML)或伴有骨髓增生相关变化(AML-MRC)的成人和1岁及以上儿童患者
用法用量
1.用法用量
周期用法用量
第一次诱导治疗第1、3和5天使用(柔红霉素44 mg/m2和阿糖胞苷100 mg/m2)脂质体
二次诱导治疗a第1、3天使用(柔红霉素44 mg/m2和阿糖胞苷100 mg/m2)脂质体
巩固治疗第1、3天使用(柔红霉素29 mg/m2和阿糖胞苷65 mg/m2)脂质体
a.仅适用于第一个诱导周期未能达到反应的患者
不良反应
最常见的不良反应(发生率≥25%)为出血性事件、发热性中性粒细胞减少、皮疹、水肿、恶心、粘膜炎、腹泻、便秘、肌肉骨骼疼痛、疲劳、腹痛、呼吸困难、头痛、咳嗽、食欲下降、心律失常、肺炎、菌血症、寒战、睡眠障碍和呕吐
禁忌
对阿糖胞苷、柔红霉素或该制剂的任何成分有严重过敏反应史患者禁用
贮存方法
在2°C至8°C避光条件下储存
适用人群
成人和1岁及以上儿童患者
药物相互作用
1.心脏毒性药物
同时使用心脏毒性药物可能会增加心脏毒性的风险,当本药与心脏毒性药物共同使用时,更频繁地评估心脏功能,例如甲胺噻嗪、丙咪嗪、柔毛霉素、阿霉素、保太松、安妥明、磺胺类、甲胺噻嗪、氯丙嗪、非那根、丙咪嗪、青霉素、链霉素、金霉素等,药物引起的心脏毒性会出现心力衰竭、心律不齐等症状
2.肝毒性药物
同时使用肝毒性药物可能会损害肝功能,并增加本药的毒性,当本药与肝毒性药物联合使用时,可以更频繁地监测肝功能,例如常用的抗结核药物,如异烟肼、利福平、吡嗪酰胺等,或抗生素药物中的红霉素、氯霉素等,以及抗真菌的酮康唑、氟康唑等,或精神科常用的药物中,如卡马西平、帕罗西汀、氟西汀等,以及心血管科常用的他汀类的降血脂药物,如普伐他汀、洛伐他汀等,另外,对乙酰氨基酚、吲哚美辛等非甾体类的抗炎药,或甲泼尼龙、泼尼松等激素类药物也能对肝细胞造成一定损伤
有效期
48个月
剂型
注射剂
生产厂家
美国Celator制药
成分
本品主要有效成分为柔红霉素和阿糖胞苷
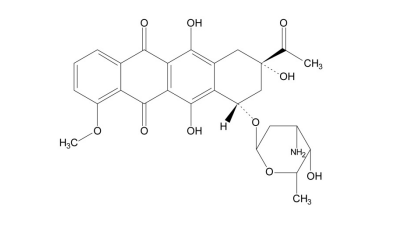
柔红霉素化学结构如下:
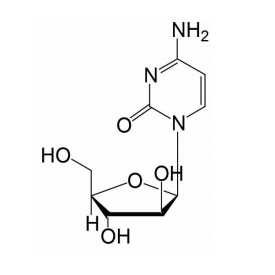
阿糖胞苷化学结构如下:
性状
一种无菌的、不含防腐剂的紫色冻干饼,用于重组,以单剂量透明玻璃瓶提供,含有柔红霉素44 mg,阿糖胞苷100 mg
注意事项
1.不要与其他含柔红霉素和/或含阿糖胞苷的产品交换
由于药代动力学参数存在较大差异,本药的剂量和时间表建议与盐酸柔红霉素注射液、阿糖胞苷注射液、柠檬酸柔红霉素脂质体注射液、阿糖胞苷脂质体注射液不同,在制备和给药前验证药物名称和剂量,以避免给药错误,不要用柔红霉素或阿糖胞苷的其他制剂代替本药
2.出血
在使用本药治疗的患者中发生过严重或致命的出血事件,包括致命的中枢神经系统(CNS)出血,并伴有长期严重的血小板减少症,因此,应定期监测血细胞计数,直至康复,并根据需要给予血小板输注支持
3.心脏毒性
(1)本药含有蒽环类柔红霉素,已知有心脏毒性风险,既往使用蒽环类药物治疗,既往心脏疾病,既往纵隔放疗,或同时使用心脏毒性药物可能会增加柔红霉素诱导心脏毒性的风险
(2)在使用本药之前,应获得心电图(ECG)并通过多门控放射性核素血管造影(MUGA)扫描或超声心动图(ECHO)评估心功能
(3)在使用本药巩固前和临床需要时,重复MUGA或ECHO检测左室射血分数(LVEF)
(4)对于心功能受损的患者,除非开始或继续治疗的好处超过风险,否则应停止使用本药,对于左室射血分数低于正常水平的患者,不建议使用本药治疗
(5)计算每个本药治疗周期之前的终身累计蒽环类药物暴露量,对于终身接触蒽环类药物已达到最大累积限度的患者,不建议使用本药治疗
4.超敏反应
(1)柔红霉素和阿糖胞苷可引起严重或致命的过敏反应,包括过敏性反应
(2)监测患者过敏反应,如果出现轻度或中度过敏反应,中断或减缓本药输注速度并控制症状,如果发生严重或危及生命的超敏反应,应永久停用本药,根据护理标准治疗症状,并监测,直到症状消失
5.铜过载
本药含5 mg/mL葡萄糖酸铜,其中14%为单质铜,应监测血清总铜、血清非铜蓝蛋白结合铜、24小时尿铜水平和一系列神经心理检查,对有急性铜中毒症状或体征的患者停用本药
6.组织坏死
柔红霉素与药物外渗部位的严重局部组织坏死有关,本药只能通过静脉注射给药,给药前确认静脉通路通畅,请勿肌肉注射或皮下注射
7.胚胎-胎儿毒性
(1)本药在给孕妇使用时可造成胚胎-胎儿损害,应建议患者在服用本药期间避免怀孕,如果在怀孕期间使用这种药物,或者如果患者在服用这种药物时怀孕,请告知患者对胎儿的潜在风险
(2)建议具有生殖潜力的女性和男性在治疗期间和最后一次本药治疗后6个月内采取有效的避孕措施
(以上参考自FDA 美国药监局英文说明书2022.09版)



 美国Celator制药
美国Celator制药  在线咨询
在线咨询 
 中国江苏恒瑞
中国江苏恒瑞
 印度natco
印度natco
 ABLYNX制药公司
ABLYNX制药公司 用法用量
用法用量