摘要:抗病毒新机制药马立巴韦(Maribavir)纳入中国优先审评
巨细胞病毒(CMV)是目前临床上常见的一种β型疱疹病毒,是移植病人最常见的感染之一,在移植患者中的发病率为16-56%,而在造血干细胞移植病人中则高达30-70%。免疫功能正常的人被巨细胞病毒感染后,一般会出现短暂的发烧,甚至没有任何症状;移植病人(以肾移植为例)感染巨细胞病毒后,常累积全身多种器官,可能表现为发热、肺炎、肝炎、关节疼痛、白细胞减少、脑膜炎、脊髓炎等多种临床症状。之后,巨细胞病毒将以终生潜伏期存在于各种细胞内,并作为再激活的储存库,使携带者更易感染(1)。现有药物不仅毒副作用大,并且患者已经产生耐药性。马立巴韦(Maribavir)的出现使得对已有药物耐药的患者多了一种新的治疗选择。
马立巴韦(Maribavir)是一种口服的抑制巨细胞病毒pUL97激酶的UL97抑制剂,它能阻止巨细胞病毒的增殖,是抗病毒疗法的新机制。2021年11月23日经FDA批准在美国上市,此前已获得FDA认证的突破性疗法和优先审评资格,值得注意的是,它是美国食品及药物管理局核准的首个、也是唯一一个对传统的抗病毒疗法抵抗的移植后巨细胞病毒感染(有或没有基因型抵抗)的药物(2),2022年11月,欧洲药监局批准该药于欧洲上市,获批适应症均为用于治疗成人和儿童患者(12岁及以上,体重至少35公斤),移植后的巨细胞病毒(CMV)感染/疾病,这些患者难以用更昔洛韦、盐酸缬更昔洛韦片、西多福韦或膦甲酸治疗(伴或不伴耐药)。
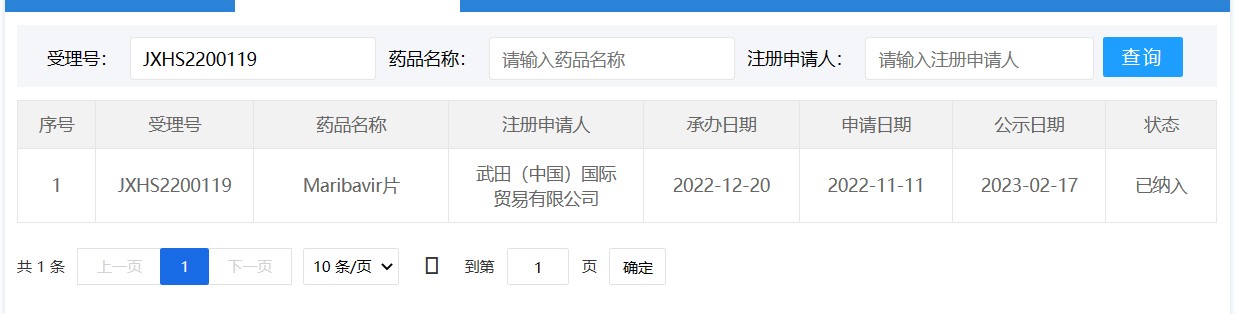
虽然马立巴韦暂未在中国上市,但在中国针对治疗巨细胞病毒(CMV)感染或疾病的临床试验已经展开(苏州大学附属第一医院承办,登记号:CTR20201035),且已经被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种,2023年2月17日,被中国国家药监局药品审评中心拟纳入优先审评(3),这意味着距离它的获批更进一步,希望这种新机制的抗病毒治疗药物能够早日获得批准,让更多的移植后巨细胞病毒感染者受益。
马立巴韦获批于一项多中心、随机、开放标签、活性对照的3期优势试验(NCT02931539),试验中,研究者指定治疗药物(IAT)(更昔洛韦、盐酸缬更昔洛韦片、西多福韦或膦甲酸)为一组,352例使用更昔洛韦、盐酸缬更昔洛韦片、西多福韦或膦甲酸治疗无效的巨细胞病毒(CMV)感染造血干细胞移植(HSCT)或固体或单器官移植(SOT)患者使用马立巴韦为另一组,对比得出马立巴韦的疗效和安全性(4)。
主要疗效终点是巨细胞病毒(CMV)DNA水平<LLOQ(即<137 IU/mL)(第8周末评估),由COBAS® AmpliPrep/COBAS® TaqMan® CMV测试评估。关键的次要终点是在研究第8周结束时巨细胞病毒(CMV)DNA水平<LLOQ和巨细胞病毒(CMV)感染症状控制,并将这种治疗效果保持到研究第16周。
主要终点:马立巴韦组:55.7%>IAT组:23.9%
关键次要终点:马立巴韦组:18.7%>IAT组:10.3%
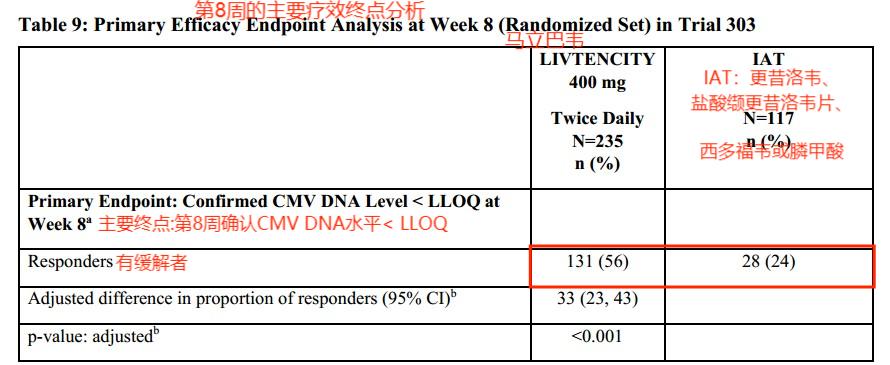
以上结果说明,巨细胞病毒感染患者服用马立巴韦后,有接近6成患者巨细胞病毒数量137 IU/mL,而传统治疗方法只有二成多患者达到了这个数据,马立巴韦有效率是传统治疗方法的而2~3倍左右。在治疗持久性方面来讲,服用马立巴韦的患者的有效率也接近传统治疗方法的2倍。
突发不良事件(TEAEs)发生率相似:马里巴韦,97.4% VS IAT,91.4%
急性肾损伤:马立巴韦 8.5%<膦甲酸21.3%
中性粒细胞减少:马立巴韦 9.4%<盐酸缬更昔洛韦片/更昔洛韦 33.9%
因突发不良事件(TEAEs)而中止治疗的患者:马立巴韦 13.2%<IAT 31.9%,每组有一名患者出现致命的治疗相关突发不良事件。
以上数据表明,马立巴韦相比于传统治疗药物,突发不良事件相似,但严重不良反应发生率明显减少,因不良反应停药患者也减少,安全性在可接受范围内。
对于患有巨细胞病毒的移植患者来说,马立巴韦在巨细胞病毒清除和病毒清除加症状控制方面优于IAT,并在治疗后保持。与IAT相比,马里巴韦因不良反应而中断治疗的情况较少(5)。
苏州大学附属第一医院血液科主任吴德沛教授说:“目前,国内血液内科医师在诊断和治疗上都遇到了一个共同的难题,那就是移植手术术后感染,尤其是巨细胞病毒(CMV)感染,由于其严重程度和严重程度,应该受到高度关注。马立巴韦是当前世界范围内最受关注的抗巨细胞病毒新药,我们期待着它早日进入中国患者的视野(6)。”


 马立巴韦
马立巴韦 片剂
200mg
 日本武田
日本武田
适用于治疗更昔洛韦、缬更昔洛韦、西多福韦或膦甲酸钠治疗难治的移植后巨细胞病毒 感染/疾病成人和儿童患者
2025-08-28 21:55:12
2025-08-28 21:50:16
2025-08-28 21:41:17
2025-08-28 21:37:10
2025-08-28 21:25:19
2025-01-15 11:15:49
2025-01-15 10:58:29
2025-01-14 17:18:56
2025-01-14 17:10:53
2025-01-14 16:58:46