

玛伐凯泰适用于治疗有症状性梗阻性肥厚型心肌病(梗阻性HCM)的成人。
 美国施贵宝
美国施贵宝  用法用量
用法用量 副作用
副作用  注意事项
注意事项  适应症
适应症  药物相互作用
药物相互作用 通用名:马瓦卡坦(Mavacamten)
商品名:CAMZYOS
适应靶点
心脏肌球蛋白:通过选择性抑制心脏肌球蛋白活性,减少心肌收缩力。
改善心肌收缩与舒张功能:降低左心室流出道梗阻,改善心脏充盈压。
适应症和适应人群
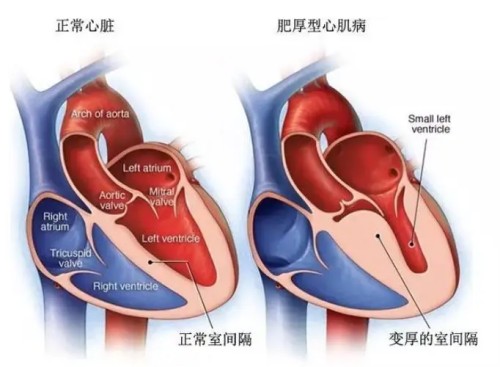
适应症:用于治疗症状性纽约心脏协会(NYHA)II-III级梗阻性肥厚型心肌病(HCM)患者,以改善功能能力和症状。
适应人群:适用于成年患者,其左心室射血分数(LVEF)≥55%,且存在静息状态或诱发后的左心室流出道峰值梯度≥50 mmHg。
规格与性状
规格:胶囊剂,包含2.5 mg、5 mg、10 mg和15 mg四种规格。
性状:
2.5 mg:浅紫色胶囊帽,印有“Mava”和剂量标识。
5 mg:黄色胶囊帽,印有“Mava”和剂量标识。
10 mg:粉色胶囊帽,印有“Mava”和剂量标识。
15 mg:灰色胶囊帽,印有“Mava”和剂量标识。
主要成分
活性成分:马瓦卡坦
辅料:交联羧甲纤维素钠、羟丙甲纤维素、甘露醇等。
用法用量
初始剂量:推荐起始剂量为5 mg,每日一次,不受进食影响。
剂量调整:根据患者临床状态和超声心动图评估结果进行剂量调整。允许的后续剂量为2.5 mg、5 mg、10 mg或15 mg,每日一次。最大推荐剂量为15 mg,每日一次。
治疗中断:如果患者在治疗期间出现LVEF <50%或心力衰竭症状,需中断治疗。具体中断和重启方案需根据患者的具体情况制定。
特殊人群
肝功能不全:轻度(Child-Pugh A)至中度(Child-Pugh B)肝功能不全患者无需调整剂量,但需密切监测。
肾功能不全:轻度至中度肾功能不全患者无需调整剂量,但需谨慎使用。
不良反应
1、常见不良反应(发生率>5%)
神经系统:头晕(27%)、晕厥(6%)。
其他:心力衰竭(可能表现为呼吸困难、腿部水肿、胸痛等)。
2、严重不良反应
心力衰竭:马瓦卡坦可能因收缩功能降低导致心力衰竭。治疗前及治疗期间需定期进行超声心动图评估LVEF,如LVEF <50%或出现心力衰竭症状,需中断治疗。
注意事项
心力衰竭风险:治疗期间需定期监测LVEF,如出现LVEF <50%或心力衰竭症状,需中断治疗。
药物相互作用:避免与中度至强效CYP2C19抑制剂或强效CYP3A4抑制剂联用,以免增加心力衰竭风险。
胚胎-胎儿毒性:可能对胎儿造成伤害。建议育龄期女性在治疗期间及停药后4个月内采取有效避孕措施。
CAMZYOS REMS计划:因心力衰竭风险,马瓦卡坦仅通过CAMZYOS REMS计划提供。患者需在该计划下接受治疗并遵循监测要求。
特殊人群用药
孕妇:基于动物实验数据,马瓦卡坦可能对胎儿造成伤害。建议育龄期女性在治疗前确认未怀孕,并在治疗期间及停药后4个月内采取有效避孕措施。
哺乳期妇女:尚不明确马瓦卡坦是否会通过乳汁分泌。建议哺乳期妇女在治疗期间暂停哺乳。
儿童:尚不明确马瓦卡坦在儿童患者中的安全性和有效性。
老年人:65岁及以上老年患者的安全性和有效性与年轻患者相当,无需调整剂量。
肝功能不全:轻度至中度肝功能不全患者无需调整剂量,但需密切监测。
肾功能不全:轻度至中度肾功能不全患者无需调整剂量,但需谨慎使用。
禁忌症
马瓦卡坦(Mavacamten)在以下情况下禁用:
1、与中等强度或强效的CYP2C19抑制剂,以及强效CYP3A4抑制剂联合使用。
2、与中等强度或强效的CYP2C19诱导剂,以及中等强度或强效的CYP3A4诱导剂联合使用。
药物相互作用
CYP450抑制剂:与弱效CYP2C19抑制剂或中度CYP3A4抑制剂联用可能增加心力衰竭风险。如需联用,需降低马瓦卡坦剂量并增加监测频率。
CYP450诱导剂:与中度至强效CYP2C19或CYP3A4诱导剂联用可能降低马瓦卡坦的疗效,需避免联用。
其他药物:马瓦卡坦可能降低某些CYP3A4、CYP2C9和CYP2C19底物的血药浓度,需密切监测。
药物过量
症状:可能包括LVEF降低、心力衰竭、低血压和心搏停止。
处理:立即停用马瓦卡坦,采取医学支持措施维持血流动力学稳定,并监测左心室功能。如在服药后2小时内,可考虑使用活性炭(成人剂量50 g)。
药代动力学
吸收:口服生物利用度至少为85%,达峰时间(Tmax)为1至2小时。
分布:血浆蛋白结合率为97%-98%。
代谢:主要通过CYP2C19(74%)、CYP3A4(18%)和CYP2C9(8%)代谢。
排泄:终末半衰期在CYP2C19正常代谢者中为6至9天,在CYP2C19不良代谢者中延长至23天。
贮存方法
温度:20°C至25°C(68°F至77°F),允许短期存放于15°C至30°C(59°F至86°F)。
防护:原包装密封,避光防潮。
研发公司
Bristol-Myers Squibb Company(百时美施贵宝公司)
用前须知:确认有生育能力的女性未妊娠并采取有效的避孕措施,不建议LVEF(左心射血分数)<55%的患者使用马瓦卡坦治疗或上调剂量。
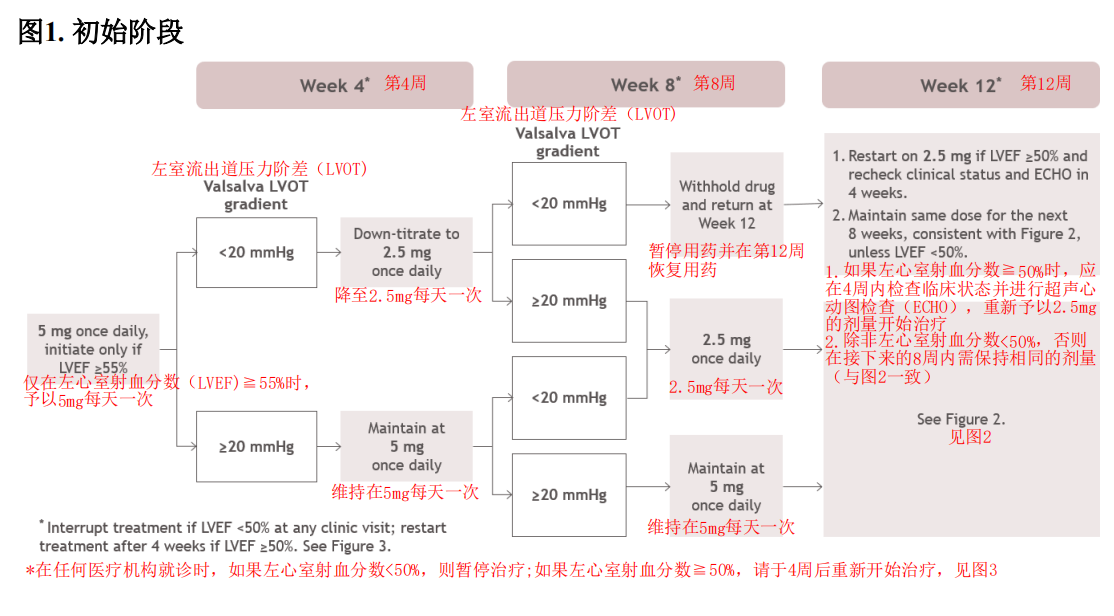
一、推荐剂量
1.起始剂量:5 mg口服,每日一次,不受进食影响。后续可根据需要调整为2.5 mg、5 mg、10 mg或15 mg,每日一次,最大推荐剂量为15 mg。
2.定期评估:需定期评估LVEF和Valsalva左心室流出道(LVOT)梯度,以确保达到适当的治疗目标并避免心力衰竭。
3.稳态时间:每日给药需数周才能达到稳态药物水平。
4.剂量调整原则:首先考虑LVEF,再考虑Valsalva LVOT梯度和患者临床状态。
5.LVEF下降处理:若LVEF < 50%,应中断治疗,并根据中断算法指导后续处理。
6.并发疾病处理:存在可能损害收缩功能的并发疾病或心律失常时,应延迟剂量增加或考虑中断治疗。
二、遗漏或延迟给药
1、尽快补服,但不要在同一天内重复给药。
2、整粒吞服胶囊,不要折断、打开或咀嚼。
三、同时服用弱CYP2 C19或中效CYP3A4抑制剂
1.稳定治疗患者:以5 mg起始剂量开始治疗。
2.开始抑制剂治疗患者:将马瓦卡坦剂量降低一个水平,并在抑制剂开始治疗后4周进行临床和超声心动图评估,12周内不得上调剂量。
3.2.5 mg剂量患者:避免同时使用弱CYP2C19和中效CYP3A4抑制剂,因为无法进一步降低剂量。
服用马瓦卡坦最常见的不良反应为:头晕和晕厥。
1、心力衰竭
马瓦卡坦减少心肌收缩力,可能引发或加重心力衰竭,特别是在已存在心脏功能受损或严重并发症(如严重感染、未控制的心律失常)的患者中。
在治疗前和治疗期间,应定期评估患者的左心室射血分数(LVEF),并根据情况调整药物剂量。LVEF低于55%的患者通常不建议开始治疗。
2、导致心力衰竭或丧失有效性的CYP450药物相互作用
马瓦卡坦主要通过CYP2C19和CYP3A4酶代谢。与这些酶发生相互作用的药物(如奥美拉唑、埃索美拉唑、西咪替丁等)可能导致严重的不良反应,包括心力衰竭或药物有效性丧失。
3、CAMZYOS REMS计划
由于心力衰竭的风险,马瓦卡坦仅能通过CAMZYOS REMS计划获得。
CAMZYOS REMS计划的显著要求包括:
1)处方医生必须通过参加CAMZYOS REMS项目获得认证。
2)患者必须入组CAMZYOS REMS项目,并遵守持续监测要求[见用法用量]。
3)药房必须通过参加CAMZYOS REMS项目获得认证,且必须仅分配给获得授权接受CAMZYOS的患者。
4)批发商和分销商必须仅分发至经认证的药房。
4、胚胎-胎儿毒性
动物实验显示,马瓦卡坦可能对胚胎-胎儿有毒性。有生育能力的女性在治疗前需确认未妊娠,并在治疗期间及末次给药后4个月内采取有效避孕措施。
马瓦卡坦(Camzyos、Mavacamten)适用于治疗有症状的纽约心脏病协会(NYHA)II-III级梗阻性肥厚型心肌病(HCM)成人患者,以改善功能能力和症状。
CYP450抑制剂:与弱效CYP2C19抑制剂或中度CYP3A4抑制剂联用可能增加心力衰竭风险。如需联用,需降低马瓦卡坦剂量并增加监测频率。
CYP450诱导剂:与中度至强效CYP2C19或CYP3A4诱导剂联用可能降低马瓦卡坦的疗效,需避免联用。
其他药物:马瓦卡坦可能降低某些CYP3A4、CYP2C9和CYP2C19底物的血药浓度,需密切监测。


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


执业药师 专注于肿瘤免疫靶向药


肿瘤内科 专注研究多种癌症的治疗


执业药师 专注于肿瘤免疫靶向药


执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



执业药师 专注于肿瘤免疫靶向药



肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗


肿瘤内科 专注研究多种癌症的治疗



肿瘤内科 专注研究多种癌症的治疗



肿瘤内科 专注研究多种癌症的治疗



肿瘤内科 专注研究多种癌症的治疗



 在线咨询
在线咨询