摘要:半年注射一次!长效HIV新药lenacapavir在欧盟获批
2022年8月22日,吉利德科学(Gilead Sciences)宣布,lenacapavir(Sunlenca®
)注射剂和片剂获得欧盟委员会的上市许可,用于联合其他抗逆转录病毒药物治疗多重耐药的HIV-1感染成人患者。这是lenacapavir在全球范围内的首次获批,同时也是长效HIV治疗药物的一个新里程碑。

人类免疫缺陷病毒(HIV),即艾滋病病毒,是逆转录病毒的一种。HIV主要侵犯人体免疫系统,导致免疫功能缺陷,引起各种感染和肿瘤的发生,最终发展为艾滋病(AIDS,获得性免疫缺陷综合征),对人类健康造成了极大威胁。
过去40年间,HIV感染的治疗已经取得了非常大的进步,抗逆转录病毒疗法(ART)是目前唯一能有效控制病毒复制的方法,它扭转了艾滋病的治疗格局,在预防疾病进展方面非常有效,艾滋病不再意味着死亡,而是变成了一种可控的慢性疾病。
在取得卓越疗效的同时,传统抗逆转录病毒疗法也存在一些局限性:
(1)一方面,由于HIV变异非常快,长期用药使得患者对抗逆转录病毒药物产生耐药性,最终导致治疗失败;
(2)另一方面,为了阻止病毒大量复制对免疫系统造成损伤,HIV感染者需要每天甚至终生服用药物,一旦停药,体内的HIV会迅速反弹。这也是逆转录病毒疗法尚未完全普及的原因之一,据统计,目前全世界仅有59%的HIV感染者接受抗逆转录病毒疗法治疗,多数感染者无法坚持每天口服药物,并且治疗费用累积起来也是一笔不小的负担;
(3)此外,抗逆转录病毒药物副作用严重,患者依从性差也是一个关键问题。
总而言之,对于既往接受过多种抗逆转录病毒方案的多重耐药患者而言,目前仍存在尚未满足的医疗需求,抗逆转录病毒药物未来应朝着长效、低耐药的方向发展,减轻患者的服药负担,停药后也能将病毒水平控制在安全范围内是科学家们努力的目标。
近两年,长效HIV治疗药物的探索逐渐获得了一些成功。2021年1月,ViiV Healthcare研发的Cabenuva(卡博特韦和利匹韦林的联合制剂)获得美国药监局(FDA)批准,这是第一个治疗成人HIV-1感染的长效药物,每个月给药一次,一年需给药12次。
而更惊人的是,Lenacapavir的出现使得这一数字变得更低,作为全球第二个获批的长效HIV治疗药物,它只需半年注射一次,将患者每年的治疗剂量从365天降至2天,实现了新的飞跃。
Lenacapavir是一种首创的HIV-1衣壳蛋白抑制剂,作用机制为通过干扰病毒生命周期的多个重要步骤来抑制HIV-1的复制。优势在于半衰期短、长效,并且和目前获批的抗逆转录病毒治疗药物没有交叉耐药性。
Lenacapavir的获批是基于2/3期CAPELLA试验(NCT04150068)的积极数据,该研究的主要结果发表在《新英格兰医学杂志》2022年5月11日的期刊中。此外,第29届逆转录病毒和机会性感染会议(Virtual CROI 2022)中发表了该研究的最新进展。
lenacapavir治疗多重耐药的HIV-1感染者的临床试验
该研究共纳入72例患者,旨在评估lenacapavir每6个月作为皮下注射,与其他抗逆转录病毒药物联合用于多重耐药的HIV-1感染患者的抗病毒活性。
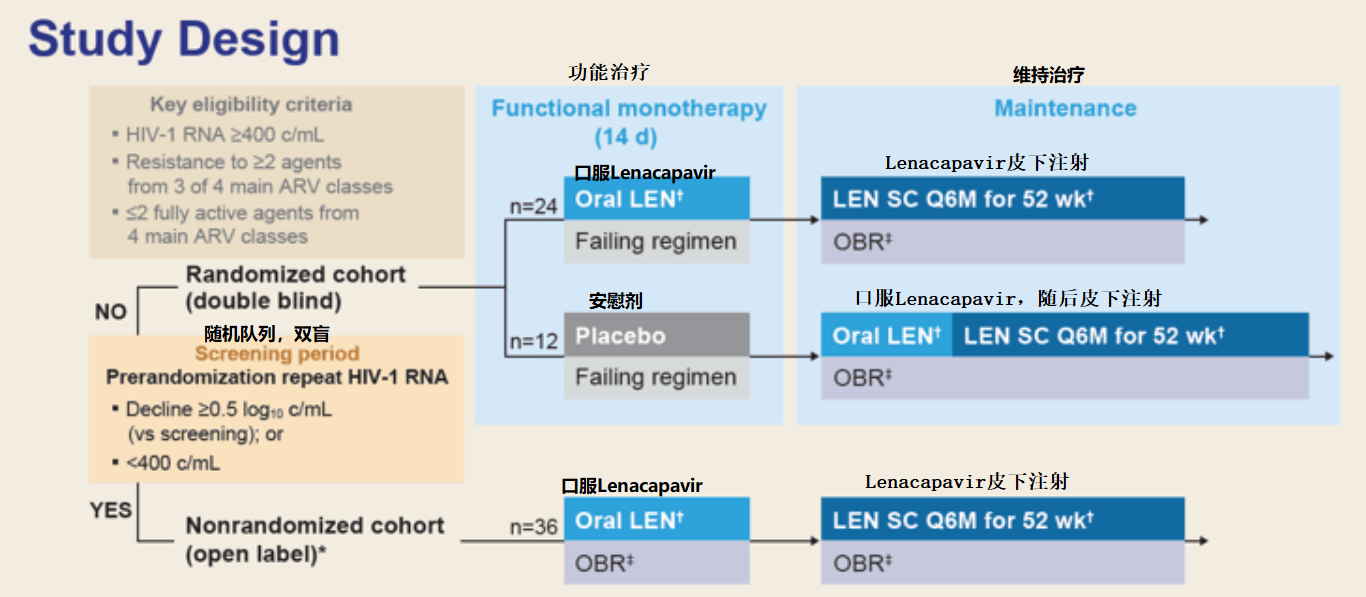
入组受试者随机分为两个队列:
(1)队列1共36例受试者,随机分为两组,第1组的24例受试者前15天接受口服lenacapavir联合入组前的抗病毒方案治疗,第15天开始进行lenacapavir皮下注射治疗(每6个月一次),并联合新的优化治疗方案;第2组的12例受试者前15天接受安慰剂联合入组前的抗病毒方案治疗,第15、16天接受口服lenacapavir联合优化治疗方案,第22天口服lenacapavir,第29天进行lenacapavir皮下注射(每6个月一次)。
(2)队列2所有患者均接受口服lenacapavir联合优化治疗方案,随后进行lenacapavir皮下注射(每6个月一次)。
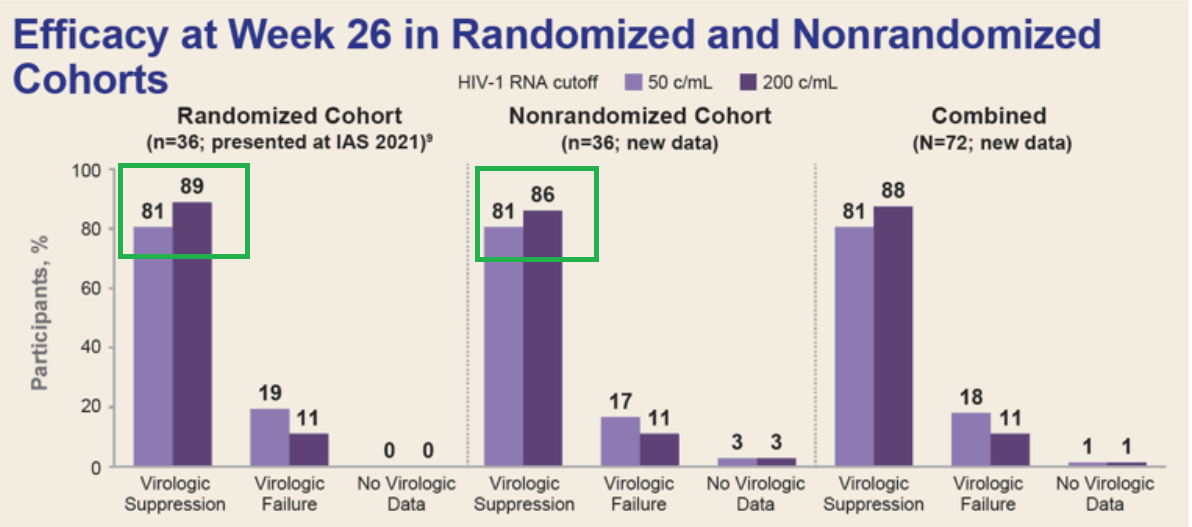
该研究的主要终点为截至第15天,和基线相比,血浆HIV-1 RNA减少至少0.5 log10拷贝/ml的患者比例;次要终点为皮下注射lenacapavir开始后第26周,病毒载量低于50拷贝/ml的患者比例,以及病毒载量低于200拷贝/ml的患者比例。
队列1的前15天接受lenacapavir的24例患者中,有21例(88%)患者的HIV-1 RNA减少0.5 log10拷贝/ml,而安慰剂组的12例患者中有2例(17%),且接受lenacapavir的患者的病毒载量降低的幅度更大。
第26周时,在队列1的36例患者中,有29例(81%)患者的病毒载量低于50拷贝/ml,32例(89%)患者的的病毒载量低于200拷贝/ml;在队列2的36例患者中,有30例(83%)患者的病毒载量低于50拷贝/ml,31例(86%)患者的病毒载量低于200拷贝/ml。
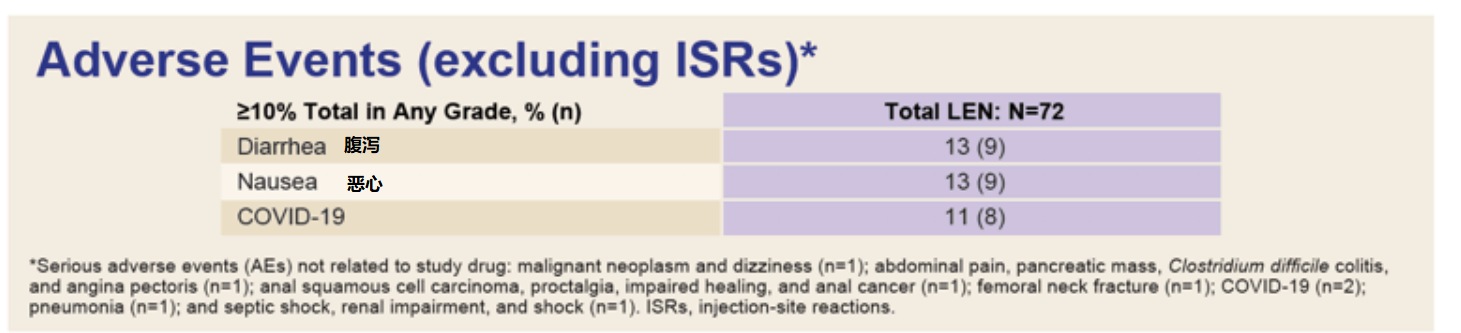
在研究期间,没有出现与lenacapavir相关的严重不良事件,也没有报告没有临床相关的3级或4级实验室异常。最常见的不良事件是腹泻、恶心、注射部位反应和COVID-19等,大多数为轻度至中度,总体来说耐受性良好。
lenacapavir与其他抗逆转录病毒药物联合治疗,每6 个月皮下注射一次,在多重耐药的HIV-1 感染者中实现了高病毒学抑制率,同时安全性良好。
除了作为HIV感染治疗的长效疗法以外,吉利德科学还有意向探索lenacapavir作为HIV暴露前预防药物的疗效。HIV暴露前预防(PrEP)指的是尚未感染HIV的人群,在将暴露于高感染风险的环境前,通过提前服用一周左右的抗病毒阻断药物,来降低HIV感染风险。
目前该研究已经进入到临床前的灵长类动物研究阶段,初步结果表明,一次低剂量的lenacapavir皮下注射就能将HIV感染风险降低86%,高剂量的风险降低幅度更大,约为96%。
这项新的研究再次表明,lenacapavir有希望在HIV感染的预防和治疗中发挥更大的作用,未来可期。
虽然目前lenacapavir已在欧洲获批,但美国药监局对该药的审批过程可谓是一波三折,到目前为止,吉利德已经向美国药监局提出了两次新药上市申请,lenacapavir何时能获FDA批准成了大家广泛关注的话题。
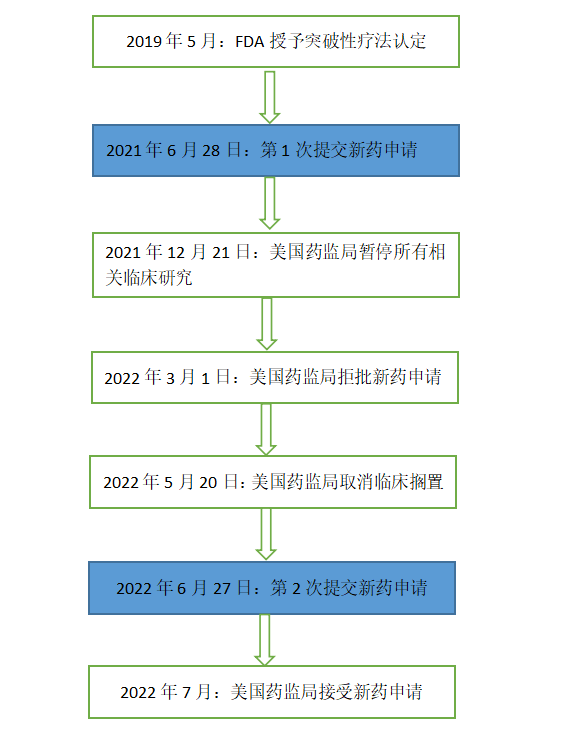
2019年5月,美国药监局(FDA)授予lenacapavir突破性疗法认定,用于联合其他抗逆转录病毒药物治疗多重耐药的HIV-1感染患者;
2021年6月28日,吉利德第一次向美国药监局提交Lenacapavir的新药申请;
2021年12月21日,由于注射用Lenacapavir和包装所用硼硅酸盐小瓶的兼容性问题,美国药监局暂停了所有Lenacapavir治疗和预防HIV的临床研究;
2022年3月1日,吉利德科学宣布,美国药监局拒绝批准Lenacapavir的新药上市申请;
2022年5月20日,吉利德将包装材质改为铝硅酸盐玻璃,美国药监局取消了Lenacapavir的临床搁置;
2022年6月27日,吉利德再次向美国药监局提出了Lenacapavir的新药上市申请;
2022年7月,美国药监局接受了吉利德重新提交的Lenacapavir新药申请,并将其处方药用户费用法案(PDUFA)日期定为2022年12月27日。
从目前的情况来看,Lenacapavir在美国上市或许即将迎来曙光,此次欧盟的批准也起到了正向的作用。无论如何,将有效药物惠及更多患者不仅是吉利德的目标,也是我们共同的目标。Lenacapavir如果将来能在美国获批,意味着又多了一种新的治疗选择,更多患者能因此获益。
2025-12-20 23:42:18
2025-12-18 20:23:21
2025-12-18 20:16:04
2025-12-18 20:08:03
2025-12-18 20:00:00
2025-12-18 19:52:46
2025-12-16 23:22:25
2025-12-16 22:31:31
2025-12-16 22:24:02
2025-12-16 22:19:54