摘要:达必妥治疗COPD的最新3期数据,使年化发生率降低了32%
2023年5月份,赛诺菲(Sanofi)和再生元(Regeneron)宣布其共同研发的白介素-4/白介素-13抑制剂度普利尤单抗(达必妥)在治疗慢性阻塞性肺疾病(COPD)患者中的3期结果,该试验结果证明了度普利尤单抗在治疗慢性阻塞性肺疾病(COPD)的良好疗效,该试验结果是在美国胸科学会(ATS)上进行宣布,其试验结果也同时发表在了《新英格兰医学杂志》(NEJM)上。

慢性阻塞性肺疾病(COPD)也叫慢阻肺,是一种以气流受限及相关呼吸道症状为主要临床表现的常见病,其发病机制尚不明确,日常生活中较为常见,并且可进行预防和治疗。慢阻肺最主要的症状为慢性咳嗽、咳痰和呼吸困难,但是这些症状不典型,容易被患者忽略,进而导致疾病的进一步加重。
早期患者仅会出现劳力性呼吸困难,后期可能会出现休息时也会出现呼吸困难,慢阻肺的“标志性症状”为活动性呼吸困难;最常见的症状为慢性咳嗽,一般以晨起和夜间咳嗽为主;痰液常为白色黏液浆液性痰。
达必妥是由赛诺菲(Sanofi)和再生元(Regeneron)共同研发的单克隆抗体,可以抑制IL-4和IL-13蛋白的信号传导。是全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂。临床试验证明,该药可以从机制上治疗2型炎症相关疾病。目前度普利尤单抗已经在全球60多个国家或地区上市,用于治疗一种或多种适应症,主要包括不同年龄段的特异反应性皮炎、哮喘、嗜酸性食管炎、结节性痒疹和慢性鼻窦炎伴鼻息肉病。
目前该药品也已经在中国上市,商品名为达必妥,规格一般为300mg/2支/盒,价格一般在5800元左右,价格仅供参考,具体以实际价格为准~
该药品针对多种适应症,因此相对应的不良反应也有不同,最常见的不良反应有:
(1)特应性皮炎(发病率≥1%)为注射部位反应、结膜炎、睑缘炎、口腔疱疹、角膜炎、眼部瘙痒、其他单纯疱疹病毒感染、干眼和嗜酸性粒细胞增多。
(2)哮喘(发病率>1%)为注射部位反应、口咽疼痛和嗜酸性粒细胞增多。
(3)慢性鼻-鼻窦炎伴鼻息肉(发病率≥1%)为注射部位反应、嗜酸性粒细胞增多、失眠、牙痛、胃炎、关节痛和结膜炎。
(4)嗜酸性食管炎(发病率≥2%)为注射部位反应、上呼吸道感染、关节痛和疱疹病毒感染。
(5)结节性痒疹(发病率≥2%)为鼻咽炎、结膜炎、疱疹感染、头晕、肌痛、腹泻。
本次大会公布的试验是一项名为BOREAS的3期、双盲、随机试验,该试验共招募了939名患者,被随机分到度普利尤单抗组和安慰剂组。该试验主要是为了检测度普利尤单抗在治疗中重度慢性阻塞性肺疾病患者中的疗效和安全性,主要终点为 52 周试验期间慢性阻塞性肺疾病中度或重度恶化的年化率。(中度加重定义为导致全身性糖皮质激素、抗生素或两者联合治疗的加重,严重恶化被定义为导致住院或急诊就诊或导致死亡的恶化。)
试验结果表明,慢性阻塞性肺疾病中度或重度恶化的年化发生率在度普利尤单抗组为0.78,在安慰剂组为1.10。相较于安慰剂组,度普利尤单抗组降低了0.32,即使用度普利尤单抗的患者降低了32%的年化发生率。
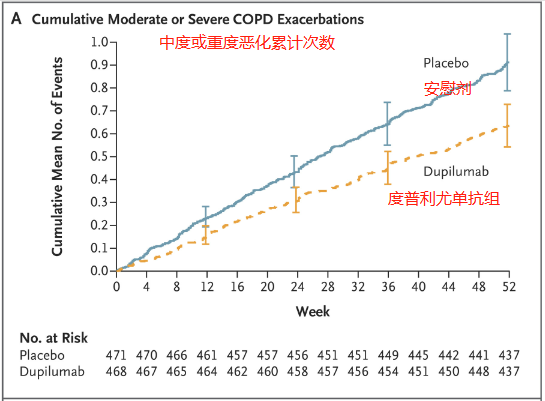
由上图可知,在中度或重度恶化累计次数中,安慰剂组明显高于度普利尤单抗组。也就是在这52周内,使用安慰剂治疗的患者恶化次数高于使用度普利尤单抗治疗的患者。
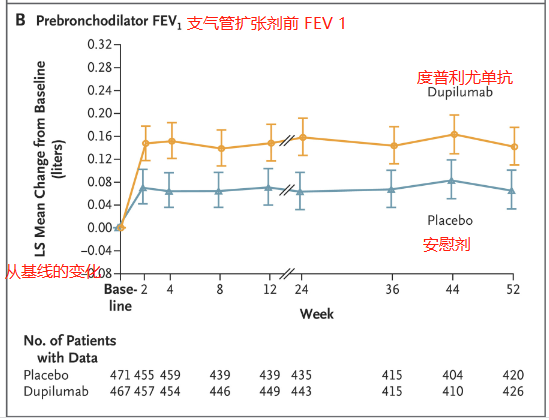
上图代表了在52周的试验期间,支气管扩张剂前 FEV 1相对于基线的变化。上图证明了使用度普利尤单抗组比使用安慰剂组有更大的改善,这种改善在开始使用度普利尤单抗或安慰剂后2周内观察到,并持续到第52周。
度普利尤单抗在多个国家上市,并且适应症有不同,以下为美国FDA公布的2022版度普利尤单抗(达必妥)所展示的适应症:
适用于治疗6个月及以上患有中度至重度特应性皮炎(AD)的成人和儿童患者,这些患者的疾病无法通过局部处方疗法得到充分控制,或者这些疗法不可取,度普利尤单抗可与或不与局部皮质类固醇一起使用
适用于6岁及以上患有以嗜酸性粒细胞表型为特征的中重度哮喘或口服皮质类固醇依赖性哮喘的成人和儿童患者的附加维持治疗
使用限制:本品不适用于缓解急性支气管痉挛或哮喘持续状态
适用于控制不充分的慢性鼻窦炎伴鼻息肉病(CRSWNP)成年患者的附加维持治疗
适用于治疗年龄在12岁及以上、体重至少为40kg、患有嗜酸性食管炎(EOE)的成人和儿童患者
适用于成人结节性痒疹(PN)的治疗
目前关于度普利尤单抗治疗慢性阻塞性肺疾病的研究还在持续进行中,目前还没有提交获批新适应症的证明,也许在不久的将来,度普利尤单抗会成为治疗慢性阻塞性肺疾病的又一“有力武器”。
 皮肤科达必妥
皮肤科达必妥 注射剂
300mg/2ml
 法国赛诺菲
法国赛诺菲
是一种全人单克隆抗体,全球首个也是唯一获批治疗成人中重度特应性皮炎的靶向生物制剂,可从机制上治疗2型炎症性疾病。
2025-12-18 20:08:03
2025-12-18 20:00:00
2025-06-24 14:43:29
2025-06-24 14:27:01
2025-06-24 14:21:23
2025-06-24 14:15:48
2025-06-24 14:06:24
2025-06-24 13:58:25
2025-06-24 13:40:29
2025-05-15 15:00:17