Firdapse(阿米吡啶)是一种用于治疗Lambert-Eaton肌无力综合征(LEMS)的药物,通过改善神经肌肉传递来增强肌肉力量和灵活性。Firdapse(阿米吡啶)凭借其独特的药理作用机制,为LEMS患者提供了一种有效的对症治疗选择。
药品名称
通用名称:amifampridine
商品名称:Firdapse
英文名称:amifampridine
中文名称:阿米吡啶
全部名称:阿米吡啶、Firdapse、amifampridine
剂型和规格
Firdapse(阿米吡啶)片剂含10毫克amifampridine,颜色为白色至灰白色,圆形,有功能性评分。每粒药片的非刻痕面上刻有“CATALYST”,刻痕面上方刻有“211”字样,下方刻有“10”。
特殊人群用药
1、妊娠期
尚无关于孕妇使用Firdapse的直接研究数据,无法准确评估其对人类孕妇及胎儿的具体风险。在动物实验中,对妊娠和哺乳期间的动物给予Firdapse导致了一系列发育毒性的表现,包括死胎和幼仔死亡增加、幼仔体重减轻以及性发育延迟。这些发育毒性现象的发生与母体血浆中的Firdapse药物水平有关。
2、哺乳期
尚无直接证据表明Firdapse(阿米吡啶)在人乳汁中的具体存在情况。在泌乳动物中,Firdapse(阿米吡啶)通过乳汁排出,并达到与母体血浆相似的水平。Firdapse(阿米吡啶)可能通过乳汁传递给婴儿,其对婴儿的具体影响尚未明确,存在潜在的风险。在决定是否使用Firdapse(阿米吡啶)进行母乳喂养时,应特别咨询医生。医生会根据母亲的临床需求和药物对婴儿的潜在风险进行综合评估。
3、儿童使用
Firdapse在治疗6岁及以上LEMS儿童患者中的适用性已经得到了证实,但其在6岁以下儿童患者中的使用仍需谨慎,建议在医生或专业医疗团队的指导下进行。
4、老年用药
Firdapse(阿米吡啶)在老年患者中的临床研究样本量有限,无法直接确定其反应是否与年轻患者相同。老年患者在使用Firdapse(阿米吡啶)时,应谨慎选择起始剂量。医生需要充分考虑患者的肝肾功能、伴随疾病和正在使用的其他药物等因素,以确保药物的安全使用。
5、肾功能损害
肾脏清除率是Firdapse(阿米吡啶)及其非活性代谢物3-N-乙酰基氨酰胺吡啶的重要消除途径之一。肾功能受损的患者在使用Firdapse(阿米吡啶)时,应特别注意初始剂量的选择和用药期间的监测与调整。对于终末期肾病患者,由于缺乏相关研究数据,无法提出明确的用药建议。
6、肝功能损害
对于有任何程度肝功能损害的患者,使用Firdapse(阿米吡啶)时应以最低推荐初始日剂量开始,并密切监测不良反应。根据临床效果和耐受性,医生可能会调整剂量或停用药物。患者应注意定期接受肝功能检查并遵循医生的用药指导。
7、NAT2代谢不良者
NAT2代谢不良时,可能会导致Firdapse(阿米吡啶)在体内的暴露量增加,增加不良反应的风险。NAT2代谢不良的患者,使用Firdapse(阿米吡啶)时应特别谨慎,建议从最低推荐初始剂量开始治疗,并密切监测临床效果和不良反应。
禁忌症
下列患者禁用Firdapse(阿米吡啶)
1、癫痫病史
2、对amifampridine或或其他氨吡啶过敏
药物相互作用
1、降低癫痫发作阈值的药物
合用Firdapse(阿米吡啶)和降低癫痫发作阈值的药物时,可能会导致癫痫发作的风险增加。
2、具有胆碱能作用的药物
合用Firdapse(阿米吡啶)和具有胆碱能作用的药物(如直接或间接胆碱酯酶抑制剂)可能会产生一系列不良的药物相互作用。
药物过量
临床研究期间未报告Firdapse(阿米吡啶)用药过量。
成分
1、有效成分:amifampridine
2、非活性成分:硬脂酸钙、胶体二氧化硅和微晶纤维素。
性状
片剂
贮存方法
1、Firdapse片剂应储存在20°C至25°C的室温环境中,允许的温度波动范围为15°C至30°C。
2、应安全地丢弃过期或不再需要的Firdapse片剂,以防止误用或对环境造成潜在危害。
3、Firdapse制备的口服混悬液应存放在2°C至8°C的冰箱中,每次制备的口服混悬液在给药之间的最长存储时间为24小时。
4、24小时后,应安全丢弃未使用的Firdapse口服混悬液,避免药物变质或污染。
5、将Firdapse(阿米吡啶)和所有药物放在儿童拿不到的地方。
生产厂家
美国BioMarin




 美国Biogen
美国Biogen  在线咨询
在线咨询 
 瑞士诺华
瑞士诺华
 印度MSN
印度MSN
 美国辉瑞
美国辉瑞
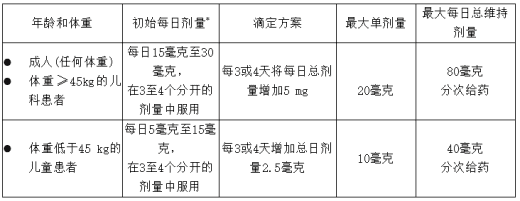
 用法用量
用法用量