恩适得(Evusheld)是一种针对新冠病毒的抗体药物,属于单克隆抗体,通过与病毒RNA上的酶活性位点结合,阻止病毒复制所需的核酸链的合成,抑制病毒在宿主细胞内的复制。
药品称呼
商品名:Evusheld
中文名:恩适得
通用名:tixagevimab, cilgavimab
全部名称:恩适得,Evusheld,tixagevimab, cilgavimab
活性成分:西加韦单抗,替沙格韦单抗
药品名称
EVUSHELD 150 mg + 150 mg注射液
定性和定量组成
每盒含2瓶:
每瓶 tixagevimab 含150 mg tixagevimab/1.5 mL(100 mg/mL)。
每瓶 cilgavimab 含150 mg cilgavimab/1.5 mL(100 mg/mL)。
通过重组 DNA 技术,在中国仓鼠卵巢 (CHO) 细胞中生产了 Tixagevimab 和cilgavimab。
药物剂型
注射液:澄清至略微浑浊、无色至淡黄色,pH 6.0溶液。
给药方法
用于肌内注射。
必须在两块不同的肌肉(首选臀肌)的不同注射部位单独连续肌内注射给予替沙格韦和西吉奥。
每盒含2瓶:
1、tixagevimab 注射液(深灰色盖子);
2、cilgavimab 注射液(白色盖子)。
注:准备好的注射器应立即给药。如果不可能立即给药,使用者有责任保证使用前的储存时间和条件,通常在2ºC-25ºC条件下不超过4小时。
禁忌症
对活性成分(西加韦单抗,替沙格韦单抗)以及辅料组氨酸、组氨酸盐酸盐一水合物蔗糖、聚山梨酯80、注射用水过敏者慎用。
药物相互作用
药代动力学相互作用
尚未进行人体相互作用研究。
预计 EVUSHELD 不会通过肝酶代谢或肾脏消除。Tixagevimab和 cilgavimab 不经肾脏排泄或经细胞色素 P450(CYP) 酶代谢;因此,不太可能与经肾脏排泄或作为 CYP 酶底物、诱导剂或抑制剂的药品发生相互作用。
根据药代动力学 (PK) 模型,EVUSHELD接种后接种 COVID-19 对 EVUSHELD 的清除无临床相关影响。
基于 PK 建模,免疫功能低下对 EVUSHELD 的清除率无临床相关影响。
药效学相互作用
尚未进行人体相互作用研究。
特殊人群用药
1、肾损害
尚未进行特定研究来检查肾损害对 tixagevimab 和 cilgavimab 药代动力学的影响。
Tixagevimab 和 cilgavimab 在尿液中不是完整消除的,因此肾损害预期不会显著影响 Tixagevimab 和 cilgavimab 的暴露。同样,透析预期不会影响 tixagevimab 和 cilgavimab 的PK。
基于群体 PK 分析,轻度 (N = 978) 或中度 (N = 174) 肾损伤患者的替格韦单抗和西吉列单抗清除率与肾功能正常患者相比没有差异。在群体 PK 模型中,重度肾损害受试者 (N = 21) 不足以得出结论。
2、肝损害
尚未进行特定研究来检查肝损害对 tixagevimab 和 cilgavimab PK 的影响。预计肝损害对 tixagevimab 和 cilgavimab PK 的影响较低。
预期 Tixagevimab 和 cilgavimab 通过蛋白水解降解成氨基酸并再循环成其他蛋白质在多个组织中分解代谢,因此肝损伤预期不会影响 Tixagevimab 和 cilgavimab 的暴露。
3、老年人
在汇总 PK 分析的2560例受试者中,21%(N = 534) 的受试者年龄≥65岁,4.2%(N = 107) 的受试者年龄≥75岁。与年轻个体相比,老年受试者(≥65岁)中的 tixagevimab 和 cilgavimab 的 PK 不存在具有临床意义的差异。
4、儿童人群
尚未在 < 18岁的个体中评价 tixagevimab 和 cilgavimab 的PK。
使用群体 PK 建模和模拟,预计推荐的给药方案在体重至少为 40 kg 的≥12岁青少年中产生的 tixagevimab 和 cilgavimab 血清暴露量与在成人中观察到的结果相当,因为在预防和治疗临床试验中纳入了体重相似的成人。
5、高体重
基于群体 PK 分析,观察到 EVUSHELD 血清浓度随体重增加而降低。体重 > 95 kg的成人肌内注射 150 mg tixagevimab 和 150 mg cilgavimab 后的平均血清浓度预计比体重 65 kg 的成人低约37%。
6、其他特殊人群
根据群体 PK 分析,性别、年龄、人种、种族、心血管疾病、糖尿病和免疫功能不全对 tixagevimab 和 cilgavimab 的 PK 无临床相关影响。
储存和处理
1、储存在冰箱中 (2℃-8℃)。
2、在原包装中避光储存。
3、请勿冷冻。
4、请勿振摇。
有效期
未开封小瓶18个月
生产厂家
AstraZeneca(英国阿斯利康)




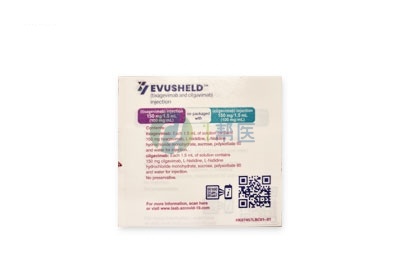


 英国阿斯利康
英国阿斯利康  在线咨询
在线咨询 
 美国强生
美国强生
 印度natco
印度natco
 德国勃林格殷格翰
德国勃林格殷格翰
 用法用量
用法用量