摘要:2022年7月27日,国家卫健委和国家中医药管理局联合印发了《关于进一步加强用药安全管理提升合理用药水平的通知》,提出要进一步加强用药安全的管理,保障医疗安全和人民健康。图源国家卫健委官网保障用药安全,药品不良反应监测是重要环节随着国内外医疗水平的不断提高,越来越多创新药物获批上市。注重提高疗效的同时,药物安全性也不可忽视。虽然任何药品都存在或多或少、或轻或重的不良反应,但有些不良反应可严重危害患
2022年7月27日,国家卫健委和国家中医药管理局联合印发了《关于进一步加强用药安全管理提升合理用药水平的通知》,提出要进一步加强用药安全的管理,保障医疗安全和人民健康。
随着国内外医疗水平的不断提高,越来越多创新药物获批上市。注重提高疗效的同时,药物安全性也不可忽视。虽然任何药品都存在或多或少、或轻或重的不良反应,但有些不良反应可严重危害患者的身体健康,影响日常生活,甚至是危及生命。
如何保障患者的用药安全是一个老生常谈的话题,近几年药品安全事故频发是对我们的又一次警醒。目前国内外多个国家包括我国,采取的一项重要措施是进行药品不良反应监测,指的是发现、评估、报告及控制不良反应的过程。
可能大家有疑问,药品上市前应该都经过了多轮临床试验的验证和相关国家机构的层层审批,为什么上市后还要对其不良反应进行监测?
主要原因为以下两点:(1)各个国家的新药审批都主要基于动物试验和部分患者临床试验的结果,首先动物与人在生理、病理上的差异无法避免,而且临床试验又存在观察时间短、样本数量有限等局限性,因此许多比较少见的不良反应或者较晚阶段才会发生的不良反应在审批时难以充分覆盖到,这就导致许多严格审批通过的药品,在正确用法用量情况下还会引发不良反应,甚至是危害生命的严重不良反应;(2)此外,多数临床试验通常排除了特殊人群(例如老人、孕妇和儿童等),有些不良反应必须在大量人群使用后才能发现[3]。
例如著名的20世纪最大的药品安全事故“反应停事件”,多个国家的妊娠期女性使用沙利度胺治疗怀孕早期的呕吐,结果导致出生的婴儿身体畸形,手脚比正常人短,严重的甚至没有手脚。截至1963年,由于服用沙利度胺,世界各地共诞生了12000多名这种像海豹一样的婴儿,酿成了无数个家庭的悲剧。沙利度胺在上市前也经过了临床试验和审批,反应停事件的惨痛教训启发我们,监测上市后药品的不良反应情况并及时反馈、加强管理非常有必要,从而防止药品不良反应的重复发生,保证患者的用药安全。

目前,世界上多个国家或地区已经建立了较为完善的药品监测体系,包括我国、英国、美国、日本、欧盟等,其中美国目前发展成为药品上市后监管体系最成熟的国家[3]。
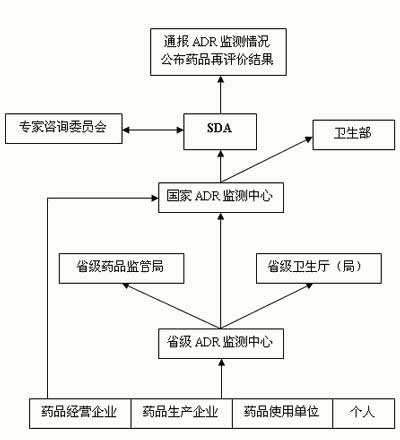
早在1999 年 11 月 26 日,国家药监局和卫生部就正式颁布了《药品不良反应监测管理办法 (试行) 》,意味着我国的药品不良反应监测工作开始进入法制化轨道。近年来,我国的药品不良反应监测工作不断推进,制度法规也在不断经历修订和完善,2004年和2011年分别进行了关键修改。
(1)已知不良反应的发生率;(2)新的不良反应的发生情况;(3)特殊人群用药的不良反应发生情况。特殊人群包括孕妇、儿童、老年人、肝肾功能损害患者、特殊种族/有基因倾向或某种合并症的患者,以及上市前临床试验缺乏安全性数据的其他人群;(4)观察到的可能与药品使用、包装、质量等相关的其他安全性问题。
国家药品不良反应监测中心主要通过《国家药品不良反应信息通报》以及《药品不良反应监测年度报告》向社会反馈监测结果。
例如,根据《国家药品不良反应监测年度报告(2021年)》显示,报告严重不良反应或不良事件数量最多的药品为肿瘤药,占比33.2%,且肿瘤用药的严重报告比例最高,为43.0%[4]。
其中,近几年PD-1/PD-L1类新型肿瘤用药较为热门,2018年我国批准了第一个PD-1抗肿瘤药纳武利尤单抗,此后3年又有十多个PD-1/PD-L1药品上市,包括特瑞普利单抗、信迪利单抗、卡瑞利珠单抗、阿替利珠单抗等。随着PD-1/PD-L1类肿瘤药物的临床需求不断增加,它们的用药安全也成为重点。通过对这些药品进行不良反应的监测,可以让患者了解可能发生的不良反应及处理措施,从而积极配合医生治疗、合理用药,获取最大的健康利益。
《药品不良反应报告和监测管理办法》规定,我国对以下药品进行不良反应监测和报告:
(1)国产药品:新药监测期(自批准生产之日起计算,不超过5年)内的国产药品应当报告该药品的所有不良反应;其他国产药品,报告新的和严重的不良反应。
(2)进口药品:进口药品从第一次获批进口开始,5年内应报告所有不良反应; 满5年的进口药品应报告新的和严重的不良反应。
根据目前的实施情况,为了避免漏报的现象,原则上是“可疑即报”。
需要。俗话说“是药三分毒”,不仅化学药品会引起不良反应,中药也会。如果不遵循中医治疗原则或者治疗不当,可能使中药不良反应/事件发生的风险增加,因此中药的不良反应也应引起重视[3]。
省级药品监部门根据不良反应评价情况可采取暂停生产、销售、使用和召回药品等措施;国家药品监管部门在必要时可采取责令修改药品说明书,暂停生产、销售、使用和召回药品,撤销药品批准证明文件等措施。
【温馨提示】以上方法仅供参考,如果对所购药品的质量存在质疑,建议咨询专业医生或药师,或向相关部门举报。
2023-03-28 11:57:32
2023-03-30 11:44:50
2022-05-08 13:17:30
2022-05-09 18:28:01
2022-05-10 14:44:49
2022-05-20 13:19:48
2022-05-26 15:43:46
2022-05-27 09:57:45
2022-05-31 10:33:48
2022-05-31 17:39:36